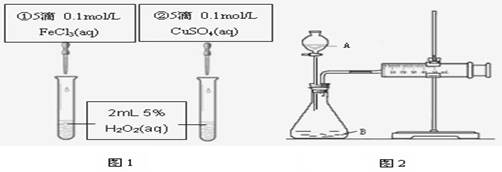
为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
| A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B.若图1所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间 |
| D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原 |
人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。据此判断氧化银是
| A.负极,并被氧化 | B.正极,并被还原 |
| C.负极,并被还原 | D.正极,并被氧化 |
科学家最近发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”也有人称之为“零号元素”,第二种是由四个氧原子构成的分子,下列有关这两种粒子的说法不正确的是
| A.“四中子”不显电性 |
| B.“四中子”的质量数为4,其质量比氢原子大 |
| C.第二种粒子是氧元素的另一种同位素 |
| D.第二种粒子的化学式为O4 ,与O2互为同素异形体 |
2011年3月12日日本福岛几组核电站受强地震的影响连续爆炸,造成严重的核泄漏。据报道在核电站附近检测到主要的两种放射性物质为:碘-131和铯-137,下列关于碘-131的说法正确的是:
| A.位于第四周期第VIA族 |
| B.碘-131的摩尔质量为131g |
| C.碘的原子核内有131个质子 |
| D.碘-131原子中中子数与核外电子数之差为25 |
一定条件下,合成氨气反应达到平衡时,测得混合气体中氨气的体积分数为25% ,若反应前后条件保持不变,则反应后缩小的气体体积与反应前的体积比值为
| A.1/5 | B.1/4 | C.1/3 | D.1/2 |
如图所示装置中,可观察到电流表指针偏转,M棒变粗,N棒变细。下表所列M、N、P物质中,可以组合成该装置的是
| 选项 |
M |
N |
P |
| A |
锌 |
铜 |
稀硫酸 |
| B |
铜 |
铁 |
稀盐酸 |
| C |
银 |
锌 |
硝酸银溶液 |
| D |
锌 |
铁 |
硝酸铁溶液 |