火箭推进器常以联氨(N2H4)为燃料、过氧化氢为助燃剂。已知下列各物质反应的热化学方程式:
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH1=-533.23 kJ·mol-1
H2O(g)=H2O (l) DH2=–44 kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g) DH3=–196.4 kJ·mol-1
则联氨与过氧化氢反应的热化学方程式可表示为
| A.N2H4(g)+2H2O2(l)= N2(g)+4H2O(l)ΔH=+817.63 kJ·mol-1 |
| B.N2H4(g)+2H2O2(l)= N2(g)+4H2O(g)ΔH=-641.63 kJ·mol-1 |
| C.N2H4(g)+2H2O2(l)= N2(g)+4H2O(l)ΔH=-641.63 kJ·mol-1 |
| D.N2H4(g)+2H2O2(l)= N2(g)+4H2O(g)ΔH=-817.63 kJ·mol-1 |
用NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.lmol Na2O2晶体中共含有4NA个离子 |
| B.常温常压下16gO2和O3混合气体含有NA个氧原子 |
| C.0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| D.17g的氢氧根离子中含有的电子数为9NA |
下列有关化学用语使用正确的是
A.CO2的电子式: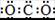 |
B.核内有8个中子的碳原子: |
C.F-离子结构示意图: |
D.HCN分子的结构式:H-C≡N |
化学在人类生活中扮演着重要角色,以下应用正确的是
| A.使用无磷洗衣粉,可彻底解决水体富营养化问题 |
| B.为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 |
| C.研发高效低毒的农药,可降低作物的农药残留量 |
| D.天然药物无任何毒副作用,可长期服用 |
常温下,把pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系正确的是()
| A.c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | B.c(Na+)+c(H+)>c(CH3COO-)+c(OH-) |
C.c(CH3COO-)>c (Na+)>c(H+)=c(OH-) (Na+)>c(H+)=c(OH-) |
D.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是()
A Al3+Na+NO-3 Cl- B K+ Na +Cl- NO3-
+Cl- NO3-
C K+ Na+ Cl-AlO2- D K+ NH+4 SO42-NO3-