某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在下方的括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案。 
并写出有关离子方程式
聚-3-羟基丁酸酯(PHB)常用于制造可降解塑料等。PHB是由3-羟基丁酸[CH3CH(OH)CH2COOH]分子聚合而成。合成聚-3-羟基丁酸酯的途径很多,其中有一种途径的副产物少、污染小、原子利用率高,其合成路线如下: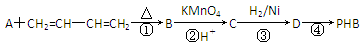
已知: 
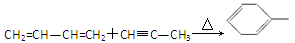
请回答下列问题。
(1)写出C中含有的官能团的名称:____________。
(2)上述转化过程中属于加成反应的是________(填序号)。
(3)反应②符合绿色化学思想(碳原子的有效利用率为100%),则A的结构简式为__________________。
(4)写出反应④的化学方程式:_____________________________________
_______________________________________________________________。
(5)写出与C互为同分异构体,能发生银镜反应,且核磁共振氢谱有两组吸收峰的有机物的结构简式:____________________________________________。
已知某芳香族化合物A的水溶液显酸性,遇FeCl3不显色,可发生下列转化(如图所示)。其中I为五元环状化合物;J可使溴水褪色;I和J互为同分异构体;K和L都是医用高分子材料。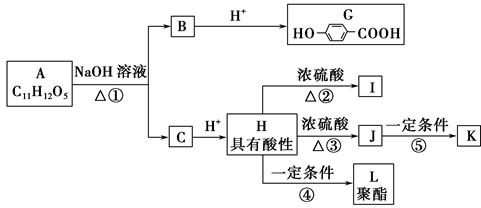
请回答下列问题。
(1)A的结构简式为______________。
(2)写出下列反应的反应类型:反应③属于________反应,反应④属于________反应。
(3)写出反应②和⑤的化学方程式。
②_______________________________________________________________,
⑤______________________________________________________________。
(4)写出符合下列要求的G的同分异构体______________________________。
①含有苯环;②能发生银镜反应,不能发生水解反应;③在稀NaOH溶液中,1 mol该同分异构体能与2 mol NaOH反应;④只能生成两种一氯代物。
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等。这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用。请回答下列问题:
(1)N4分子是一种不稳定的多氮分子,这种物质分解后能产生无毒的氮气并释放出大量能量,能被应用于制造推进剂或炸药。N4是由四个氮原子组成的氮单质,其中氮原子采用的轨道杂化方式为sp3,该分子的空间构型为________,N—N键的键角为________。
(2)基态砷原子的最外层电子排布式为________。
(3)电负性是用来表示两个不同原子形成化学键时吸引键合电子能力的相对强弱,是元素的原子在分子中吸引共用电子对的能力。由此判断N、P、As、Sb的电负性从大到小的顺序是______________。
(4)联氨(N2H4)可以表示为H2N—NH2,其中氮原子采用的轨道杂化方式为________,联氨的碱性比氨的碱性________(填“强”或“弱”),其原因是________________________________________________________________。
写出N2H4与N2O4反应的化学方程式:____________________。
(5)元素X与N同周期,且X的原子半径是该周期主族元素原子半径中最小的,X与Ca形成的化合物CaX2的晶胞结构如图所示: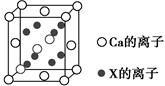
CaX2的晶体类型是________,一个晶胞中含有Ca的离子数为________,含有X的离子数为________。
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质。回答下列问题(相关回答均用元素符号表示):
(1)R的基态原子的核外电子排布式是____________。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是________________________________________________________________________。
(3)X与Z中电负性较大的是________。Z的某种含氧酸盐常用于实验室制取X形成的单质,此酸根离子的空间构型为________,此离子中所含化学键的类型是________,X—Z—X的键角________109°28′(填“>”、“<”或“=”,已知:孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力)。
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为________,与一个X离子距离最近的所有的Y离子为顶点的几何体为________。该化合物与MgO相比,熔点较高的是________。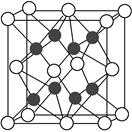
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为________g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为________,含有离子键、________等化学键。
(2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型为________,中心原子的杂化方式为________。
(3)反应物中电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图:________。
(4)Al单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。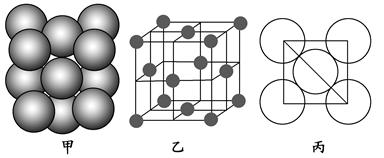
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为________;Al晶体的密度为________(用字母表示)。