某同学用容量瓶配制NaCl溶液,加水时超过了刻度线,这时正确的操作是………( )
| A.把水倒出一些,再准确定容 |
| B.用滴管吸水到凹液面与刻度线相切 |
| C.将溶液倒出来,标记为“NaCl溶液(浓度未知)” |
| D.尽量估准多出的水量,根据所配浓度,加入相应量的NaCl固体 |
己知Ksp(AgCl) =1.56×10-10,Ksp(AgBr) =7.7×10-13,Ksp(Ag2CrO4)=9×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.0l0mol/L,向该溶液中逐滴加入0.0l0mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
| A.Cl-、Br-、CrO42- | B.CrO42-、Br-、Cl- |
| C.Br-、Cl-、CrO42- | D.Br-、CrO42-、Cl- |
常温时,M(OH)2的Ksp=4×10-6,将0.32mol/L的MCl2溶液与pH为12的氨水等体积混合,有关叙述不正确的是( )
| A.混合溶液中的Cl-离子浓度为0.32mol/L |
| B.混合后溶液中c (NH4+)/c (NH3·H2O)比值变小 |
| C.混合溶液对于M(OH)2为饱和溶液 |
| D.会有M(OH)2沉淀生成 |
下列有关说法正确的是( )
| A.锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了H+浓度 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| D.镀锌铁镀层破损后锌仍能减缓铁腐蚀,其原理为牺牲阳极的阴极保护法 |
25℃,测得0.1 mol/L的NaA溶液的pH=8,则下列关系式不正确的是( )
A.c (A-) +c (HA) =0.1mol/L B.c (Na+) -c (A-)=1×10-6-1×10-8mol/L
C.c (OH-) -c (HA)=1×10-8mol/L D. c(Na+)>c(OH-)>c(A-)>c(H+)
常温下向20 mL 0.1mol/LCH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )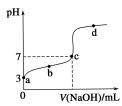
| A.a点表示的溶液中c(CH3COO-)略小于10-3 mol/L |
| B.b点表示的溶液中c(CH3COO-)>c(Na+) |
| C.c点表示CH3COOH和NaOH恰好完全中和 |
| D.滴定过程中溶液中的n (CH3COO-) +n(CH3COOH)的和不变 |