(1)在某容积不变的密闭容器中,有可逆反应: mA(g)+nB(g) pC(g)+qD(S)+Q(Q>0)如图某反应过程中各物质物质的量n(mol)随时间t(nub)的变化曲线图。
mA(g)+nB(g) pC(g)+qD(S)+Q(Q>0)如图某反应过程中各物质物质的量n(mol)随时间t(nub)的变化曲线图。
达到化学平衡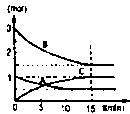
①该反应的平衡常数表达式为(各物质浓度的指数用数值表示):
。
②若充入A,K值 (填一定增大、一定减小、或可能增大也可能减小、不变);正反应速率____(填增大、减小、不变)。
③若体积为10升的密闭容器中,500℃、有催化剂存在的条件下,根据图示回答下列问题:在0~15min内的平均反应速率:v(B)=  (2)对于某可逆反应:A(g)+B(g) 2C(g)+Q(Q>0)。
(2)对于某可逆反应:A(g)+B(g) 2C(g)+Q(Q>0)。
若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空: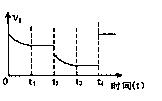
①写出t 2时改变的条件可能是: (用文字表达);
2时改变的条件可能是: (用文字表达);
②t4时改交的条件可能是 (用编号表示,多选扣分)
A.增大压强 B.减小压强
C.使用催化剂 D.升高温度
E.增大A的浓度
Ⅰ.(1)下图为1molNO2(g)和1molCO(g)反应生成NO(g)和 CO2(g)过程中的能量变化示意图。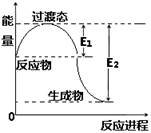
已知E1=134KJ/mol,E2=368KJ/mol(E1、E2为反应的活化能)。若在反应体系中加入催化剂,反应速率增大,则E1、△H的变化分别是(填“增大”、“减小”或“不变”)。写出该反应的热化学方程式。
(2)若反应SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)在150℃下能自发进行,则△H ____ 0
A.大于 B.小于C.等于D.大于或小于都可
Ⅱ.以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:
2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) △H=QkJ/mol (Q>0)
CH3CH2OH(g)+3H2O(g) △H=QkJ/mol (Q>0)
在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。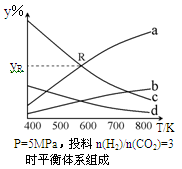
完成下列填空:
(1)表示CH3CH2OH体积分数曲线的是____(选填序号)。
(2)在一定温度下反应达到平衡的标志是。
A.平衡常数K不再增大
B.CO2的转化率不再增大
C.混合气体的平均相对分子质量不再改变
D.反应物不再转化为生成物
(3)其他条件恒定,达到平衡后,能提高H2转化率的措施是_______(选填编号)。
A.升高温度B.充入更多的H2
C.移去乙醇 D.增大容器体积
(4)图中曲线a和c的交点R对应物质的体积分数yR=_______。
[化学---选修2:化学与技术](15分)银、铜均属于重金属,从银铜合金废料中回收银并制备含铜化合物产品的工艺如图所示: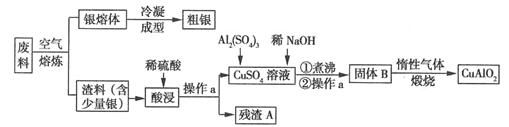
(1)熔炼时被氧化的元素是,酸浸时反应的离子方程式为。为提高酸浸时铜元素的浸出率及浸出速率,酸浸前应对渣料进行处理,其处理方法是。
(2)操作a是,固体B转化为CuAlO2的过程中,存在如下反应,请填写空白处:
CuO+Al2O3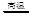 +↑。
+↑。
(3)若残渣A中含有n mol Ag,将该残渣全部与足量的稀HNO3置于某容器中进行反应,写出反应的化学方程式。为彻底消除污染,可将反应中产生的气体与V L(标准状况)空气混合通入水中,则V至少
为L(设空气中氧气的体积分数为0.2)。
(4)已知2Cu+  Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点。
Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点。
(5)假设粗银中的杂质只有少量的铜,利用电化学方法对其进行精炼,则粗银应与电源的极相连,当两个电极上质量变化值相差30.4 g时,则两个电极上银质量的变化值相差g。
(14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) H1
H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) H2
H2
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l) H=。(请用含有
H=。(请用含有 H1、
H1、 H2的式子表示)
H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) |
平衡时NH3的物质的量(mol) |
| T1 |
2.4 |
| T2 |
2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)=,平衡时N2的转化率α(N2)=。
③下列图像分别代表焓变(H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是。
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
①M区发生的电极反应式为。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500 mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量
为g(假设溶液电解前后体积不变)。
[化学---选修3:物质结构与性质] (15分)太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)铟与镓同是IIIA族元素,写出铟基态原子的电子排布式:。
(2)硒为第四周期VIA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为。(用元素符号表示)
(3)SeO3分子的立体构型为。
(4)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是。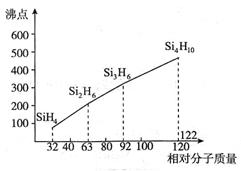
(5)硼元素具有缺电子性,其化合物往往具有加合性,如硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-,其中B原子的杂化类型为。
(6)金属铜投入氨水中或投入H2O2溶液中均无明显现象,但投入氨水—过氧化氢混合液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子方程式:。
(7)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为;若该晶体的晶胞参数为a pm,则该合金密度为g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
[化学——选修3物质结构与性质]现有aA、bB、cC、dD、eE、gG六种短周期非金属元素,a+b=c,a+c=d,a+d=e,d+e=g,C、E、G的单质均有在中学常见的两种或多种同素异形体,请回答下列问题:
Ⅰ.(1)C、D、E元素的第一电离能由大到小的关系为__________。(用元素符号表示)
(2)请比较C2A4、D2A4、G2A4三种化合物的沸点由高到低的顺序为______________。(用化学式表示)
(3)有某种分子式为C4D4E8的物质(该物质中同种原子的化学环境完全相同,不含碳碳双键)是一种威力极强的炸药,则可推知其结构简式为____________。
Ⅱ.BG是一种耐磨材料,其结构与金刚石相似,下图为其晶体结构单元,它可由B的三溴化物和G的三溴化物于高温下在氢气的氛围中合成。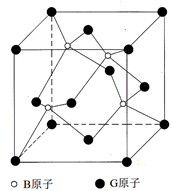
(1)指出B的三溴化物中B的杂化方式为________G的三溴化物分子的结构为_______型。
(2)写出合成BG的化学反应方程式为____________________。
(3)已知晶体中B与G原子的最近距离为a pm,则该晶体的密度的表达式为____g/cm3。(不需化简)