CH3OH(g)+H2O(g) CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
(1)在其它条件不变的情况下降低温度,则逆反应速率 (填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率 。
(2)一定条件下,向体积为2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),20s 后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 。
(3)判断该可逆反应达到平衡状态的依据是(填序号) 。
A v正(CH3OH)=v正(CO2)
B 混合气体的密度不变
C 混合气体的平均相对分子质量不变
D CH3OH、H2O、CO2、H2的浓度都不再发生变化
(4)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向逆反应方 向移动的是 (填序号)。
A.升高温度 B.降低温度 C.增大压强
(1)回答下列问题:
① CH2=CH-CH=CH2 键线式__________;
② 的结构简式___________
的结构简式___________
③芳香烃萘 的分子式为
的分子式为
(2)写出下列有机物的系统命名或结构简式(6分):
①2,2-二甲基-3-乙基己烷 ;
②CH3CH(CH3)C(CH3)2CH2CH3 ;
③ 。
。
I.(1)鉴别KCl溶液和K2CO3的试剂是 ,除去SO2中的HCl的试剂是 。
(2)除去Na2CO3粉末中混入的NaHCO3杂质用 方法。分离碘和CCl4的操作方法 。
(3)除去混入Fe2O3中少量SiO2杂质的试剂是 ,离子方程式为 。
II.氧化还原反应在工农业生产和日常生活中有广泛的应用,回答下列问题:
(4)罐头厂在装食品罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质,此类食物防腐剂应具有________。(填“氧化性”或“还原性”)
(5)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而Fe2+更容易被吸收,服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中维生素C所起的作用是 。(填“氧化剂”或“还原剂”)
(6)氯气是一种重要的工业原料且HCl遇NH3会产生NH4Cl,NH4Cl为白色固体。工业上利用反应:3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是________。
| A.若管道漏气遇NH3就会产生白烟 | B.该反应利用了Cl2的强氧化性 |
| C.该反应属于复分解反应 | D.生成1 mol N2有6 mol电子转移 |
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ/mol
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=+32.4kJ/mol
则相同条件下,反应C3H8(g)═CH3CH=CH2(g)+H2(g)的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH =5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二步电离,则H2CO3 HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= mo1/L。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mo1/L NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用简要的文字明)。
(1)乙醇的分子结构如右图: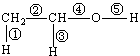 ,其中①②③④⑤表示化学键的代号,用代号回答:
,其中①②③④⑤表示化学键的代号,用代号回答:
i乙醇与钠反应断裂的键是_
ii乙醇与氧气在铜或银作催化剂,加热条件下反应断裂的键是
(2)把一端弯成螺旋状的铜丝放在酒精灯外焰部分加热,看到铜丝表面变成 色。趁热将它反复插入盛乙醇的试管中,铜丝表面又变成 色,并有 气味的物质生成,总反应的化学方程式 。
某种苯的同系物0.1mol完全燃烧,生成的气体通过浓H2SO4后,使浓H2SO4增重10.8g,此种苯的同系物在苯环上的一溴取代物只有一种,则苯的同系物的分子式为 ,结构简式为 。