海水是巨大的资源宝库。从海水中提取食盐和溴的过程如下:
 |
 (1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br¯,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式,并用双线桥法标出电子转移的方向与数目。
(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br¯,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式,并用双线桥法标出电子转移的方向与数目。
 (2)
(2) 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下装置简图:
某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下装置简图:
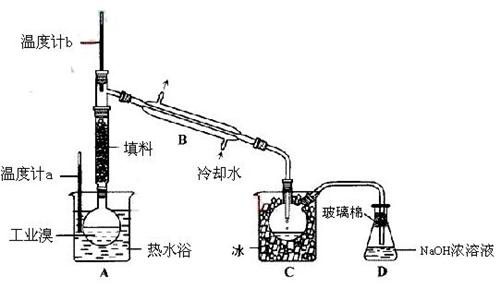

 请你参与分析讨论:
请你参与分析讨论:

 ①图中仪器B的名称: 。
①图中仪器B的名称: 。
 ②
②  实验装置气密性良好,要在C中获得纯净的液溴即达到提纯溴的目的,操作中如何控制关键条件: 。
实验装置气密性良好,要在C中获得纯净的液溴即达到提纯溴的目的,操作中如何控制关键条件: 。
 ③为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,则发生的反应方程式为
③为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,则发生的反应方程式为
充分反应后,再进行的分离操作是 。
(10分)有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
其单质是密度最小的物质 |
| B |
阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C |
其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D |
其氢氧化物和氧化物都有两性,与C同周期 |
| E |
与C同周期,原子半径在该周期最小 |
回答下列问题:
(1)、写出下列元素的名称:B、_______,C、_______ ,D、_______,E、________;
(2)、写出A、B、C形成的化合物M的电子式;
(3)、实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为________;
(4)、E单质与M的水溶液反应的离子方程式:。
下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
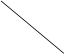 族 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
① |
⑥ |
② |
|||||
| 三 |
③ |
⑤ |
④ |
⑩ |
⑦ |
⑧ |
||
| 四 |
⑨ |
(1)、在这些元素中,化学性质最不活泼的原子的原子结构示意图为______________;
(2)、地壳中含量最多的金属元素是________,写出元素⑥③以原子个数比1:1形成化合物的电子式__________;
(3)、这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是;
(4)、写出②.⑦.⑩对应离子还原性由强到弱的次序。
(1) 用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:
①、计算机芯片的主要成分是,(填名称)
②、光导纤维的主要成分是;(填名称)
(2)硅是地壳中含量很高的元素,其单质和化合物在新型和传统非金属材料中用途广泛
①、写出工业上用碳单质还原二氧化硅制备硅的化学反应方程式;
_________________________________________________________,
②、用方程式表示为什么不能用有玻璃塞的试剂瓶存放碱性溶液
。
一定的温度下向2L密闭容器中通入2molSO2和2molO2,发生反
应: 2SO2+O2 2SO3.5min后达到平衡,测得容器中有SO31.6mol.
2SO3.5min后达到平衡,测得容器中有SO31.6mol.
回答下列问题:
(1)反应5min内,v(O2)=_________mol.L-1.min-1.
(2)化学反应达到平衡时,SO2消耗的浓度占起始浓度的百分比为__________;此时,容器中c(O2)=_______,压强是起始时的_______倍.
(3)判断该反应达到平衡的标志是_______________;
| A.v消耗(SO2)=v生成(SO3) | B.混合气体的平均相对分子质量不再改变 |
| C.混合气体的密度不再改变 | D.容器中气体的总物质的量不再变化 |
我国是世界上最大的耗煤国家,但每年占总产量70%的煤都被直接烧掉,既浪费了资源又污染环境。因此开发新能源是国家能源发展的方向。
试回答下列问题:
(1)已知1.12LCH4(标况)完全燃烧生成二氧化碳和液态水,可放出44.5KJ的热量,则其热化学方程式为__________;
(2)人们常用“热值”来衡量燃料燃烧放出的热量的大小。“热值”是指常温常压下,1g物质完全燃烧生成稳定物质放出的热量。则CH4的热值是________KJ.g-1
(3)氢气是一种清洁能源,它不仅热值高,而且原料丰富。氢氧燃料电池是以氢气为燃料,氧气是氧化剂,以氢氧化钾为电解质溶液的燃料电池,试写出正、负极的电极反应式:
正极_______________________ ,负极________________________________.
(4)若以上述氢氧燃料电池作电源,以碳棒为阳极电解100mL饱和食盐水,则阳极的电极反应式为__________________________;当电路中通过0.2mol电子时,阳极可产生的气体____________L(标况下),此时溶液中氢氧化钠的物质的量浓度为________mol.L-1(假设电解前后溶液体积不变).