A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。
请回答下列问题:
(1)A的化学式为 ,在水中的溶解性 (选填“易溶”、“可溶”、“难溶”)。
(2)H溶液中通入过量的CO2,其反应的离子方程式是 。
G→J的化学方程式为 。
反应的现象是 。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因 。
【化学——选修3:物质结构与性质】A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素。A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子。请回答下列问题:
(1)元素E的名称为_____,D的基态原子价层电子排布式为______ 。
(2)C的氢化物的沸点比其上一周期同族元素的氢化物低,是因为___。
(3)A、C电负性大小顺序是__________(用元素符号表示),C的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为_____。
(4)A、B形成的化合物的晶胞如图所示,该晶胞的化学式为______,中A离子的配位数为__________,该晶体类型为___________。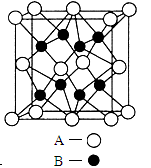
(5)该晶胞的边长为a×10-10 cm,则距离最近的A、B离子间的距离为__________cm。
【化学——选修2:化学与技术】氮的化合物是重要的化工原料,在工农业生产中有很多重要应用。工业上合成氨的流程示意图如下: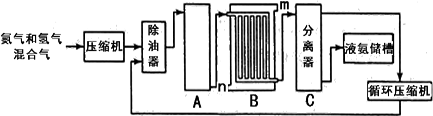
回答下列问题:
(1)25℃时合成氨反应热化学方程式为:N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ/mol。在该温度时,取1 mol N2和3 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4 kJ。其原因是______________。
2NH3(g)ΔH=-92.4 kJ/mol。在该温度时,取1 mol N2和3 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4 kJ。其原因是______________。
(2)原料氢气的来源是水和碳氢化合物,写出工业生产中分别采用煤和天然气为原料制取氢气的化学反应方程式:,。
(3)设备B的名称是________,其中m和n是两个通水口,入水口是(填“m”或“n”),不宜从相反方向通水的原因。
(4)设备C的作用是。
(5)为了提高其产量,降低能耗,近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是;与传统的合成氨的方法比较,该方法的优点是。
煤可以通过气化和液化转变为清洁能源并提高燃烧效率。
煤气化的主要反应是:C(g)+ H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
气化得到的CO和H2可以进一步液化合成甲醇,反应方程式为:
CO(g)+2H2(g) CH3OH(g)∆H
CH3OH(g)∆H
(1)若相同温度下CO、H2、CH3OH(g)的燃烧热(∆H)分别为a、b、c,则上述反应的∆H=。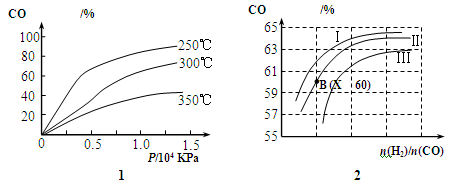
(2)图1表示CO的转化率与温度、压强之间的关系,图2表示CO的转化率与起始投料比n(H2)/n(CO)、温度的变化关系,曲线I、Ⅱ、Ⅲ对应的温度分别为T1、T2、T3,则T1、T2、T3的大小关系为,理由。测得B(X,60)点氢气的转化率为40%,则X=。
(3)一定条件下,将2 mol CO和4 mol H2置于容积为2 L固定的密闭容器中发生上述反应,反应达到平衡时H2的物质的量为2 mol,则此时CH3OH(g)的物质的量浓度为,平衡常数K=。下列说法中能说明反应已达到平衡状态的是(填选项前的字母)。
| A.混合气体的平均摩尔质量不变 |
| B.一氧化碳的消耗速率等于甲醇的生成速率 |
| C.CO和H2的物质的量之比保持不变 |
| D.混合气体的密度不变 |
[化学──选修3 :物质结构与性质]X、Y 、Z、W为元素周期表前四周期的元素。其中X原子核外的L层电子数是K层电子数的两倍, Y的内层电子数是最外层电子数的9倍,Z在元素周期表的各元素中电负性最大,W元素的第三电子层处于全充满状态且第四电子层只有2个电子。请回答下列问题。
(1)W元素属于区元素,其基态原子的电子排布式为。
(2)W2+能与氨气分子形成配离子[W(NH3)4]2+。其中配体分子的空间构型为,写出该配离子的结构简式(标明配位键)。
(3)X能与氢、氮、氧三种元素构成化合物XO(NH2)2,其中X原子的杂化方式为,1 mol 该分子中σ键的数目为,该物质易溶于水的主要原因是。
(4)X的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为。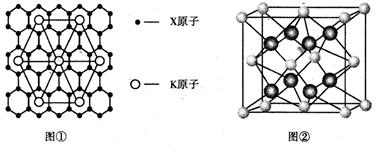
(5)元素Y与元素Z形成的晶体结构如图②所示,设晶胞中最近的Y的离子与Z的距离为a pm,该化合物的摩尔质量为bg/ mol ,则该晶胞密度的计算式为g/cm3。
[化学──选修2 :化学与技术]工业上以黄铁矿(FeS2)为原料,采用接触法生产硫酸的流程图如下。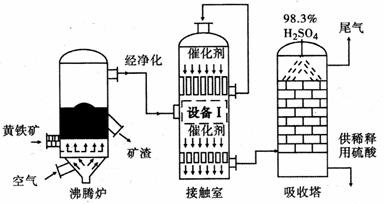
(1)黄铁矿在沸腾炉中反应的化学方程式为。
(2)为充分利用反应放出的热量,接触室中应安装(填“设备Ⅰ ”的名称)。
(3)原料气在一定条件下通入接触室中,测量各截面过程气体流中各种气体的物质的量的百分含量如下,则该过程中SO2的平衡转化率为(精确到 0. l )。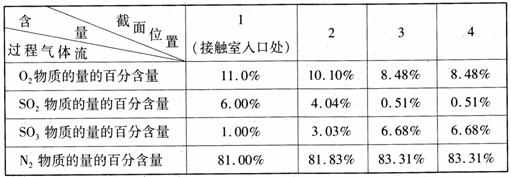
(4)在吸收塔中将SO3转化成硫酸,使用98.3 %的硫酸从上方喷淋,而不使用水的理由是。吸收塔中填充有许多瓷管,其作用是。
(5)尾气中常含有N2、O2、SO2、微量的SO3等。为了综合利用尾气,可将其通人氨水中,再按一定比例加人碳酸氢铵,降低温度析出含结晶水的晶体。已知该结晶水合物的相对分子质量为134 , 则其化学式为。
(6)能用于测定硫酸尾气中SO2含量的是(填标号)。
| A.NaOH溶液、酚酞试液 | B.KMnO4溶液、稀H2SO4 |
| C.碘水、淀粉溶液 | D.氨水、酚酞试液 |