I.下列实验中仪器的下端必须插入反应物液面下的是: 。(填写序号)
①制备氢气的简易装置中的长颈漏斗;②制备氯气装置中的分液漏斗; ③制备硝基苯时的温度计;④用乙醇制取乙烯时的温度计; ⑤分馏石油时的温度计。
II.完成以下实验:①
用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验。在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。试回答下列问题:
(1)试管I中反应的化学方程式 __________________。
(2)反应结束后,U形管中粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的_______________(填字母)
| A.NaOH溶液 | B.H2O | C.Na2SO3溶液 | D.CCl4 |
(3)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后__________________(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
(4)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过下图所示的装置。
用上图装置进行实验的目的是 _;上图中右边试管中的现象是 ;水的作用是 。
(5)溴乙烷(C2H5Br)多一个碳的同系物在氢氧化钠的醇溶液中能发生反应,生成的产物为_________________
合成氨尿素工业生产过程中涉及的物质转化过程如下图所示。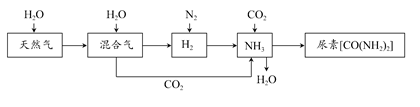
(1)天然气在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为___________________________________。
(2)在合成氨生产中,将生成的氨气及时从反应后的气体中分离出来。运用化学平衡的知识分析这样做是否有利于氨的合成,说明理由:___________。
(3)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。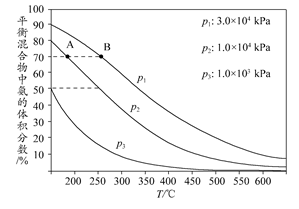
①若分别用vA(NH3)和vB(NH3)表示从反应开始至平衡状态A、B时的化学反应速率,则vA(NH3)________vB(NH3)(填“>”、“<”或“=”)。
②在相同温度下,当压强由p1变为p3时,合成氨反应的化学平衡常数________(填“变大”、“变小”或“不变”)。
③在250°C、1.0×104kPa下,H2的转化率为________%(计算结果保留小数点后1位)。
甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g)  CO2(g)+3H2(g) ΔH>0
CO2(g)+3H2(g) ΔH>0
(1)一定条件下,向体积为2 L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),20 s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为________。
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号)________。
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1 mol CH3OH(g)和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为a L。试回答: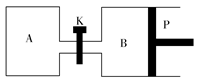
①反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为________,A、B两容器中H2O(g)的体积百分含量的大小关系为:B(填“>”“<”或“=”)________A。
②若打开K,一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。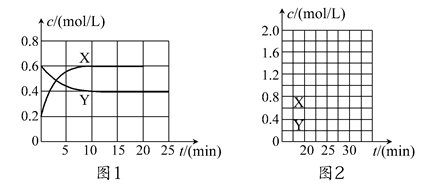
请回答:
(1)图l中,曲线________(填“X”或“Y”)表示NO2浓度随时间的变化情况;前10 min内v(NO2)=________mol/(L·min)。
(2)下列选项中不能说明该反应已达到平衡状态的是________(填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而变化 |
(3)反应进行到10 min时,共吸收热量22.76 kJ,则该反应的热化学方程式为_________________________________;该反应的平衡常数K=________。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10 min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为ω1,达到新平衡后混合气体中NO2的体积分数为ω2,则ω1________ω2(填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。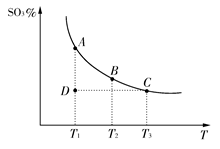
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)  2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)2SO2(g)+O2(g)  2SO3(g)的ΔH________0(填“>”或“<”);若在恒温;恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不”);
2SO3(g)的ΔH________0(填“>”或“<”);若在恒温;恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不”);
(2)若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1________K2;若反应进行到状态D时,v正________v逆(填“>”“<”或“=”);
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3)/mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
下列说法正确的是 ( )
A.反应在前50 s 的平均速率v(PCl3)= 0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)= 0.11 mol·L-1,则反应的ΔH<0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率大于80%