能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)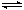 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g)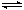 CH3OH(g) ΔH2
CH3OH(g) ΔH2
①反应I的平衡常数表达式为K=________________________
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH2________0,ΔS______0 (填“>”、“=”或“<”=)。
③对于反应II,若容器容积不变,下列措施可增加甲醇产率的是__________。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.按原比例再充入 CO和 H2 |
④某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)="0.2" mol·L-1,则CO的转化率为________,此时的温度为_______(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-1275.6 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ΔH =-566.0 kJ·mol-1
③ H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式____________________。
(3)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。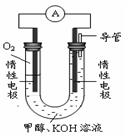
①该电池中OH-向_______极移动(填“正”或“负”)
②该电池负极的电极反应为_________________________。
③用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度为_______________,电解过程中收集到标准状况下的气体体积为__________________。
(1)工业制氢气的一个重要反应是:CO(g)+ H2O(g) ="=" CO2(g) + H2(g)
已知25℃时:C(石墨) +O2 (g) ="=" CO2(g) △H1 =-394 kJ·mol-1
C(石墨) +1/2O2 (g) ="=" CO (g) △H2 =-111 kJ·mol-1
H2(g) +1/2O2 (g)="=" H2O(g) △H3=-242kJ·mol-1
试计算25℃时CO(g)+ H2O(g) ="=" CO2(g) + H2(g)的反应热______kJ·mol-1
(2)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g)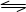 CO2(g)+H2(g);△H<0试回答下列问题:
CO2(g)+H2(g);△H<0试回答下列问题:
①若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=.
②在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)v(逆)(填“大于”“小于”或“等于”),你判断的依据是
③若降低温度,该反应的K值将,该反应的化学反应速率将(均填“增大”“减小”或“不变”)。
(1)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A萃取分液法 B加热分解 C重结晶法 D分液法 E渗析法 F蒸馏法 G过滤法
①__________分离饱和食盐水和沙子的混合物。
②___________从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
③___________分离水和煤油的混合物。
④___________分离水和酒精。
⑤__________分离溴水中的溴和水。
(2)为除去粗盐中的Ca2+、Mg2+、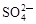 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
第④步中,相关的化学方程式是。
通过计算填空:
(1)标准状况下,有如下几种气体,
①33.6L NH3中含有的氮原子数为
②16gO2的体积是
③11.2L某气体的质量是22g,则该气体的相对分子质量为
④同温同压下,同体积的甲烷和二氧化碳分子数之比为,质量之比为。
(2)①0.5L 0.5mol/L FeCl3溶液中的Cl-的物质的量浓度为 __________。
②在mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O g。
③ 实验室欲配制物质的量浓度为0.2mol/L稀H2SO4 500mL,应用量筒量取98%的浓硫酸(密度为1.84g/mL)mL。
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
1 000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题:
(1)上述反应的正反应是____反应(填“放热”或“吸热”),该反应的平衡常数表达式为。
(2)能判断该反应是否达到化学平衡状态的依据是(填序号)。
a.容器中压强不变b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)在实际生产中,该反应的适宜条件为.
A.加压,400~500℃催化剂 B.加压,830~1000℃催化剂
C.常压,400~500℃催化剂 D.常压,830~1000℃催化剂
(4)在830 ℃时,2L的密闭容器中加入4molCO(g)和6molH2O(g),10 min后达到平衡时,CO2的平衡浓度为___________,用H2浓度变化来表示的平均反应速率为____________, CO的转化率是_________。
(5)为使该反应的反应速率增大且平衡向正反应方向移动的是___________(填字母序号).
a.增大CO浓度b.升高温度
c.将生成物分离出去 d.使用高效催化剂
(14分)I.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.5mol液态肼和1mol H2O2混合反应,生成氮气和水蒸气,放出256.5kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为。
(2)又已知H2O(l)=H2O(g) ΔH=+44.0kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是。
II.已知: (s,白磷)+
(s,白磷)+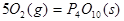



则白磷转化为红磷为____________反应(填“吸热”或“放热”);白磷的稳定性比红磷___________(填“高”或“低”)。
III.能较准确地反映丙烷燃烧时能量变化的曲线是________。