实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题
(1)制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、量筒和 。
(2)用托盘天平称取氯化钠固体,其质量为 g。
(3)若定容时俯视容量瓶刻度线,会造成所配溶液的物质的量浓度_________(偏大、偏小或无影响)。
(12分)(1)“嫦娥一号”登月成功,实现了中国人“奔月”的梦想.“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点是相同质量时,氢气放出的热量多,产物为水无污染。
已知:H2(g)+O2(g)=H2O(l) ΔH=-285.8 kJ/mol ; H2(g)=H2(l) ΔH=-0.92 kJ/mol
O2(g)=O2(l) ΔH=-6.84 kJ/mol ; H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
请写出液氢和液氧生成气态水的热化学方程式:_______________________________.
(2)已知:①NH3(g)+HCl(g)===NH4Cl(s)ΔH=-176 kJ/mol
②NH3(g)+H2O(l)===NH3·H2O(aq)ΔH=-35.1 kJ/mol
③HCl(g)===HCl(aq) ΔH= -72.3 kJ/mol
④NH3·H2O(aq)+HCl(aq)===NH4Cl(aq)+H2O(l)ΔH=-52.3 kJ/mol
则NH4Cl(s)===NH4Cl(aq)的ΔH=______
(3)分别取40 mL的0.50 mol/L盐酸与0.55 mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
① 理论上稀强酸、稀强碱反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式__
② 假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容
c=4.18 J/(g·℃).为了计算中和热,实验时还需测量的数据有(填序号)__________;
| A.反应前盐酸溶液的温度 | B.反应前盐酸溶液的质量 |
| C.反应前氢氧化钠溶液的温度 | D.反应前氢氧化钠溶液的质量 |
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
③ 某学生实验记录数据如下:
| 实验 序号 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
氢氧化钠 |
混合溶液 |
|
| 1 |
20.0 |
20.1 |
23.2 |
| 2 |
20.2 |
20.4 |
23.4 |
| 3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=____________;
④假定该学生的操作完全同上,实验中改用100 mL 0.5 mol/L盐酸跟100 mL 0.55 mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”).
(5分)某温度下1L密闭容器中加入1molN2和3molH2,使反应N2+3H2 2NH3达平衡,测得混合气体中N2、H2、NH3的量分别为m、n、gmol,如温度不变,只改变初始物质的加入量,而要求m、n、g总保持不变。若N2、H2、NH3的起始加入量用x、y、z表示时,应满足条件:
2NH3达平衡,测得混合气体中N2、H2、NH3的量分别为m、n、gmol,如温度不变,只改变初始物质的加入量,而要求m、n、g总保持不变。若N2、H2、NH3的起始加入量用x、y、z表示时,应满足条件:
(1)若x=0,y=0时z= ____mol,
(2)若x=0.25mol,则y= ____mol,z= ____mol,
(3)x、y、z应满足的一般条件是(用含x、y、z的代数式表示)。
(共11分)西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关理化性质如下表所示: 
| 分子式 |
结构简式 |
外观 |
熔点 |
溶解性 |
| C12H10ClN3O |
白色结晶粉末 |
170~172°C |
易溶于水 |
(1)氯元素基态原子核外电子的未成对电子数为。
(2)氯吡苯脲的晶体类型为_______,所含第二周期元素第一电离能从大到小的顺序为__________________。
(3)氯吡苯脲晶体中,氮原子的杂化轨道类型为_______。
(4)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。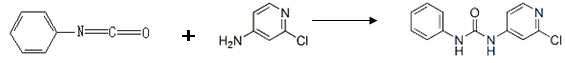
反应过程中,每生成1mol氯吡苯脲,断裂_______个σ键、断裂_______个π键
(5)波尔多液为常见杀菌剂,喷洒后生成可溶的硫酸铜溶液,加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成深蓝色透明溶液,得到配位数为4的的配合物。写出沉淀溶解的离子方程式。
(共10分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| A |
|||||||||||||||||
| B |
C |
D |
E |
F |
|||||||||||||
| G |
H |
I |
J |
K |
L |
||||||||||||
| M |
N |
||||||||||||||||
试回答下列问题:
(1)请写出元素N的基态原子电子排布式。
(2)D的氢化物易溶于水的原因
(3)D和E的电负性的大小:>(用元素符号表示)
(4)由A、C、D形成的ACD分子中,含有个σ键,个π键。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有 __________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为。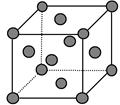
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
③在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
(共8分)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。
试回答下列问题:
(1)Ti元素的基态原子的价电子层排布图为 ;
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是;晶体内与每个“Ti”紧邻的氧原子数为个。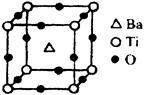
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为