(12分)(1)“嫦娥一号”登月成功,实现了中国人“奔月”的梦想.“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点是相同质量时,氢气放出的热量多,产物为水无污染。
已知:H2(g)+O2(g)=H2O(l) ΔH=-285.8 kJ/mol ; H2(g)=H2(l) ΔH=-0.92 kJ/mol
O2(g)=O2(l) ΔH=-6.84 kJ/mol ; H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
请写出液氢和液氧生成气态水的热化学方程式:_______________________________.
(2)已知:①NH3(g)+HCl(g)===NH4Cl(s) ΔH=-176 kJ/mol
②NH3(g)+H2O(l)===NH3·H2O(aq) ΔH=-35.1 kJ/mol
③HCl(g)===HCl(aq) ΔH= -72.3 kJ/mol
④NH3·H2O(aq)+HCl(aq)===NH4Cl(aq)+H2O(l) ΔH=-52.3 kJ/mol
则NH4Cl(s)===NH4Cl(aq)的ΔH=______
(3)分别取40 mL的0.50 mol/L盐酸与0.55 mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
① 理论上稀强酸、稀强碱反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 __
② 假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容
c=4.18 J/(g·℃).为了计算中和热,实验时还需测量的数据有(填序号)__________;
| A.反应前盐酸溶液的温度 | B.反应前盐酸溶液的质量 |
| C.反应前氢氧化钠溶液的温度 | D.反应前氢氧化钠溶液的质量 |
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
③ 某学生实验记录数据如下:
| 实验 序号 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
氢氧化钠 |
混合溶液 |
|
| 1 |
20.0 |
20.1 |
23.2 |
| 2 |
20.2 |
20.4 |
23.4 |
| 3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________ __;
④假定该学生的操作完全同上,实验中改用100 mL 0.5 mol/L盐酸跟100 mL 0.55 mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”).
为减少大气污染,一些城市公共汽车逐步使用CNG(压缩天然气)清洁燃料,实验测得0.16g该气体燃料,完全燃烧生成224mLCO2(标准状况)和0.36g液态水,并放出8.903KJ的热量。请写出:
CNG的化学式,其完全燃烧的热化学方程式。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知: ①Z的原子序数为29,其余的均为短周期主族元素;
①Z的原子序数为29,其余的均为短周期主族元素; ②Y原子价电子(外围电子)排布msnmpn
②Y原子价电子(外围电子)排布msnmpn  ③R原子核外L层电子数为奇数;
③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。
④Q、X原子p轨道的电子数分别为2和4。 请回答下列问题:
请回答下列问题: (1)Z2+ 的核外电子排布式是,Z原子基态时简化电子排布式为。
(1)Z2+ 的核外电子排布式是,Z原子基态时简化电子排布式为。 (2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。
| A.稳定性:甲>乙,沸点:甲>乙 | B.稳定性:甲>乙,沸点:甲<乙 |
C.稳定性:甲<乙,沸点:甲<乙 | D.稳定性:甲<乙,沸点:甲>乙 |
 (3)Q、R、Y三种元素的第一电离能数值由小到大的顺序为(用元素符号作答)。
(3)Q、R、Y三种元素的第一电离能数值由小到大的顺序为(用元素符号作答)。 (4)五种元素中,电负性最大与最小的两种非金属元素形成的化合物的化学式为。
(4)五种元素中,电负性最大与最小的两种非金属元素形成的化合物的化学式为。 (5)Q的一种氢化物相对分子质量为28,其中分子中的σ键与π键的键数之比为,该氢化物与氧气形成的燃料电池在碱性电解质中负极反应为。
(5)Q的一种氢化物相对分子质量为28,其中分子中的σ键与π键的键数之比为,该氢化物与氧气形成的燃料电池在碱性电解质中负极反应为。
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答: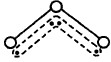
(1)臭氧与氧气的关系是。
(2)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有对孤对电子。
(3)选出下列分子与O3分子的结构最相似的的是()
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)NH4+的电子式为,N采用杂化方式,NH4+粒子空间构型为,键角为。
(2)写出二种由多个原子组成的含有与N3-价电子数相同的物质的化学式。
(3)等电子体的微粒往往具有相似的结构,试预测N3-的构型。
请根据表格回答问题:
(ⅰ)根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| E |
500 |
4600 |
6900 |
9500 |
| F |
740 |
1500 |
7700 |
10500 |
| H |
580 |
1800 |
2700 |
11600 |
| I |
420 |
3100 |
4400 |
5900 |
(1)在周期表中,最可能处于同一族的是()
A.F和H B.H和I C.E和H D.E和I
(2)它们的氯化物的化学式,最可能正确的是()
A.ECl B.FCl3 C.HCl D.ICl4
(3)F元素最可能是()
A.S区元素 B.稀有气体元素 C.p区元素D.准金属 E.d区元素
(ⅱ)右表是元素周期表的一部分: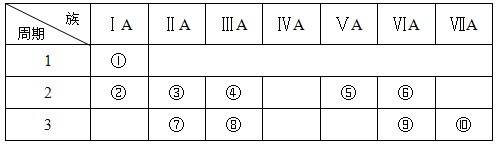
(4)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是
其原子的结构示意图是。
(5)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。这种现象被称为。
(6)又如表中与元素⑦的性质相似的不同族元素是(填元素符号)。