请根据表格回答问题:
(ⅰ)根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| E |
500 |
4600 |
6900 |
9500 |
| F |
740 |
1500 |
7700 |
10500 |
| H |
580 |
1800 |
2700 |
11600 |
| I |
420 |
3100 |
4400 |
5900 |
(1)在周期表中,最可能处于同一族的是( )
A.F和H B.H和I C.E和H D.E和I
(2)它们的氯化物的化学式,最可能正确的是( )
A.ECl B.FCl3 C.HCl D.ICl4
(3)F元素最可能是( )
A.S区元素 B.稀有气体元素 C.p区元素 D.准金属 E.d区元素
(ⅱ)右表是元素周期表的一部分: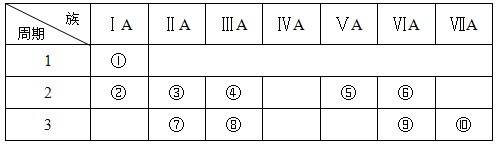
(4)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是
其原子的结构示意图是 。
(5)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。这种现象被称为 。
(6)又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)。
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
最外层电子占核外电子总数的3/8[来 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,其中子数为8,则这种同位素的符号是。
(2) Y的氢化物与Y的最高价氧化物的水化物反应生成的物质名称为:
(3)T与X形成的常见化合物的结构式为:
(4)Z所在族元素的四种氢化物水溶液中,酸性最弱的物质的化学式为:
(5)T的同主族短周期元素M,M的氢化物与T的氢化物比较,沸点较高的是(填化学式),请解释原因:
A、B、C三种主族元素在周期表中的位置相邻,它们的原子序数 依次增大。A、B原子的电子层相同,B、C原子的最外层电子数相同。已知三种元素
依次增大。A、B原子的电子层相同,B、C原子的最外层电子数相同。已知三种元素 原子的最外层电子数之和为17,质子数之和为31。
原子的最外层电子数之和为17,质子数之和为31。
写出:(1)A单质的电子式为;(2)B氢化物的结构式为;
(3)用电子式表示C氢化物的形成过程。
①日本核辐射含有一种碘(127I)的131I(填“同种原子”或“同位素”或“同素异形体”)。人体缺碘容易引发甲状腺肿大,已知碘与氯同主族,周期序数比氯大2,则其原子序数为,其最高价氧化物的化学式为,对应水化物的化学式。
②按已知的原子结构规律,116号元素应是第周期第族元素,它属于元素(填“金属”或“非金属”)。
按要求填空:
(1)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则理论上1 mol N2生成NH3___________热量(填:“吸收”或“放出”) _______kJ;事实上,反应的热量总小于理论值,理由是_______________________。
(2)X、Y两元素能形成 XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是___________;若XY2是共价化合物其结构式是____________。
XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是___________;若XY2是共价化合物其结构式是____________。
(3)第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其电子式为____________。
(4)某非金属X的最高正价为+m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是____________。
(5)X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物YX2在水溶液中能电离出电子层结构相同的离子,用电子式表示该化合物的形成过程______________ 。
Ⅰ.上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界,并画出金属和非金属的分界线,用阴影画出铁元素 所在的族。
所在的族。
Ⅱ. A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是,画出B元素简单离子结构示意图,乙物质的电子式是
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是(用元素符号填写)
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是
(4)简述比较D与E金属 性强弱的实验方法:
性强弱的实验方法:
(5)E的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用)其反应方程式为