【化学——选修2:化学与技术】
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是( )
| A.氨水 | B.硫化氢气体 | C.硫酸钠溶液 | D.纯碱溶液 |
II、合成氨的流程示意图如下:
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 ;
(2)设备A中含有电加热器、触煤和热交换器,设备A的名称 ,其中发生的化学反应方程式为 ;
(3)设备B的名称 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因 ;
(4)设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
芬必得是一种高效的消炎药,其主要成分为布洛芬,它有多种合成路线,下图所示就是一种合成方法: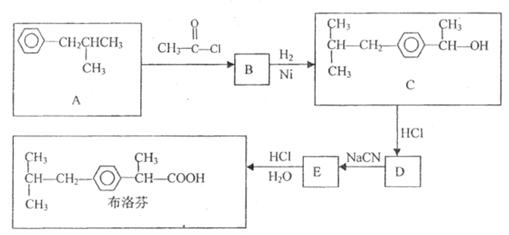
已知卤代烃有如下反应: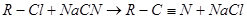
回答下列问题:
(1)B的结构简式_________________;D的分子式_________________。
(2)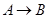 的反应类型为_________________反应;
的反应类型为_________________反应; 的反应类型为_________________反应。
的反应类型为_________________反应。
(3)有机物C和苯酚的关系是_________________(填选项字母)。
| A.互为同分异构体 | B.互为同系物 | C.均属于芳香族化合物 | D.均属于芳香醇类 |
(4)与A具有相同的分子式、且苯环上只有一个取代基的有机物共有四种,写出除A外的其余三种结构简式__________ _________________________________________。
_________________________________________。
(5) 布洛芬的化学方程式为__________________________________。
布洛芬的化学方程式为__________________________________。
一定量的铁粉在氯气中充分燃烧后,将所得固体完全溶于稀盐酸,制得溶液A。
(1)铁在氯气中燃烧的化学方程式是__________________________。
(2)推测A中可能含有的金属阳离子:①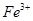 ;②只有
;②只有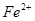 ;③_____________。
;③_____________。
甲同学为探究溶液的组成,实验如下:
| 实验步骤 |
实验现象 |
实验结论及反应离子方程式 |
| 取少量溶液A于试管中,加入KSCN溶液 |
_____________ |
假设②不成立,假设①或③成立;反应的离子方程式是___。 |
(3)乙同学继续探究溶液A的组成。
查阅资料: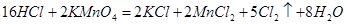
实验过程:另取少量溶液A于试管中,逐滴加入酸性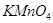 溶液,充分振荡,
溶液,充分振荡,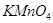 紫色褪去。
紫色褪去。
实验结论:_____________(填字母序号)。
a. 可能有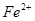 b. 可能无
b. 可能无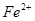 c. 一定有
c. 一定有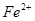
下表为元素周期表的一部分,参照元素①~⑧在表中的位置,用化学用语 回答下列问题:
回答下列问题: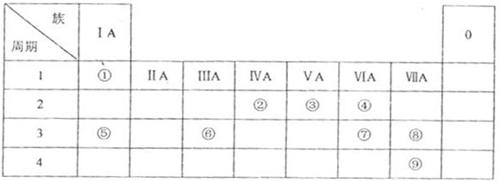
(1)④、⑤、⑦形成的简单离子的半径由大到小的顺序是____________________。
(2)含 ⑦的最高价氧化物对应水化物的稀溶液与足量⑤的最高价氧化物对应水化物的稀溶液反应放出热量
⑦的最高价氧化物对应水化物的稀溶液与足量⑤的最高价氧化物对应水化物的稀溶液反应放出热量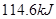 ,此反应的热化学方程式为____________________。
,此反应的热化学方程式为____________________。
(3)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为______________________________。
N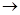 ⑥的单质的化学方程式为________________________________________。
⑥的单质的化学方程式为________________________________________。
M溶液中离子浓度由大到小的顺序为________________________________________。
(4)设计实验探究⑧、⑨两种元素非金属性的相对强弱。
可选用的试剂有:氯水、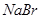 溶液、
溶液、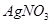 溶液、
溶液、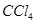 。
。
请完成实验 报告单:
报告单:
| 实验内容 |
现象 |
步骤一:试管1:取少量氯水:试管2:取少量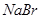 溶液,滴加少量氯水。 溶液,滴加少量氯水。 |
试管2中的现象是:____________________ |
| 步骤二:分别向试管1、试管2中加入试剂________,振荡。 |
试管2中的现象是_________________ |
| ①试管1的作用是________________________________。 ②实验结论是____________________________________________,产生该结论的原因是:同主族元素从上到下________,得电子能力逐渐减弱。 |
I. 现有下列8种物质
① ;②
;② ;③
;③ ;④HF;⑤
;④HF;⑤ ;⑥
;⑥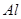 ;⑦食盐水;⑧
;⑦食盐水;⑧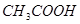
其中属于强电解质的是_____________(填序号,下同),既能跟盐酸反应又能跟 溶液反应的是_____________。
溶液反应的是_____________。
II. 现有一瓶浓度为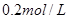 的某酸溶液,可能为醋酸、盐酸、硫酸中的一种,为了确定该酸溶液的组成进行实验:取
的某酸溶液,可能为醋酸、盐酸、硫酸中的一种,为了确定该酸溶液的组成进行实验:取 该酸
该酸 溶液,逐滴加入
溶液,逐滴加入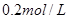 的氢氧化钠溶液,恰好反应完全时所需碱液体积为
的氢氧化钠溶液,恰好反应完全时所需碱液体积为 ,请用化学用语回答:
,请用化学用语回答:
(1)该酸不可能是____________;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为____________,用离子方程式说明溶液呈碱性的原因_________ _______________。
_______________。
III. A、B、C、D均为可溶于水的固体,组成它们的离子有:
| 阳离子 |
 、 、 、 、 、 、 |
| 阴离子 |
 、 、 、 、 、 、 |
分别取它们的水溶液进行实验,结果 如下:
如下:
①A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会消失。
②C与D反应有红褐色沉淀生成并放出气体。
③B与C反应有白色沉淀生成并放出气体。
(1)写出它们的化学式:A___________,B___________,C___________,D___________。
(2)写出③中B与C反应的离子方程式_________________________________。
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. Cl2水 D. HNO3
然后再加入适当物质 调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8. 0×10-38,Cu(OH
0×10-38,Cu(OH )2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀
)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀 完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶
完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶 液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。