Na3N是科学家制备的一种重要化合物,它与水作用可产生NH3,请回答:
(1)该化合物所形成的晶体类型属于______ __
(2)写出Na3N与水反应的化学方程式:_________________________________
(3)Na3N放入足量的盐酸中可以生成两种盐,其化学式分别为_______ ___和______ ____
有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子。现分别取溶液进行下列实验:
(1)加人淀粉溶液,未见蓝色。
(2)加人少量AgNO3溶液有黄色沉淀和气体生成。
(3)逐滴加人1mol·L-1NaOH溶液,随着NaOH溶液的滴人,产生沉淀的量如图所示。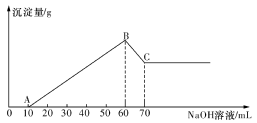
试确定:溶液中一定不存在的离子有________,其中阴离子物质的量为_________,加人少量AgNO3溶液的离子反应方程式为________________。
颠茄酸酯(J)是一种溃疡病治疗的辅助药物,其合成路线如下:
试回答下列问题:
(1)烃B其相对分子质量小于118,分子中氢的质量分数为7.69% ,且反应1为加成反应,则X的名称为________。B含有的官能团是____________。
(2)G→H 的反应类型为____________。
(3)C的结构简式为__________。
(4)反应3的化学方程式为_________________。
(5)化合物I有多种同分异构体,同时满足下列条件的结构有_______种。
①能发生水解反应和银镜反应;②能与FeC13发生显色反应;③苯环上有四个取代基,且苯环上一卤代物只有一种
(6)参照颠茄酸酯的合成路线,设计一条以 为起始原料制备
为起始原料制备 的合成路线___________________________________________。
的合成路线___________________________________________。
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g)  HCOOCH3(g)+2H2(g)△H>O
HCOOCH3(g)+2H2(g)△H>O
第二步:HCOOCH3(g)  CH3OH(g)+CO(g)△H>O
CH3OH(g)+CO(g)△H>O
第一步反应的机理可以用图1表示,中间产物X的结构简式为___________。

(2)为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X-射线衍射谱图如图2所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为:_____________。
(3)某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4、(沸点43℃),并在180℃时使Ni(CO)4重新分解产生镍单质。上述两步中消耗CO的物质的量之比为______________。
(4)为安全起见,工业生产中需对空气中的CO进行监测。使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图3 所示。这种传感器利用原电池原理,则该电池的负极反应式为:_____________________。
用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。
(1)电解过程中,a电极表面的现象是___________________________________;
(2)a电极上发生的反应为________________________________________________;
(3)从P点到Q点时收集到的混合气体的平均摩尔质量为___________ g·mol-1;
(4)如果要使溶液恢复到电解前的状态,向溶液中加入0.8 g CuO即可,则电解后溶液的pH为______;
(5)如果向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH(不考虑CO2的溶解),电解过程中转移的电子为______mol。
根据信息作答:
(1)在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
①写出上述制备小苏打的化学方程式:__________________________________。
②滤出小苏打后,母液提取氯化铵有两种方法:Ⅰ.通入氨,冷却、加食盐,过滤;Ⅱ.不通氨,冷却、加食盐,过滤。其中方法Ⅰ析出的氯化铵的纯度更高,其原因是___________。而方法Ⅱ的优点是其滤液可以_______________。
(2)铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为_____________________:PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式_________________,电解液中加入Cu(NO3)2的原因是___________________。