氨气在生产、生活和科研中应用十分广泛 。
(1)传统工业上利用氨气合成尿素
①以CO2与NH3为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.47kJ/mol
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+72.49kJ/mol
反应2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH=_____________kJmol。
②液氨可以发生电离:2NH3(l) NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式______________。
NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式______________。
(2)氨气易液化,便于储运,可利用NH3作储氢材料已知:2NH3(g) N2(g)+3H2(g) ΔH=+92.4 kJ/mol 。
N2(g)+3H2(g) ΔH=+92.4 kJ/mol 。
①氨气自发分解的反应条件是________________(填“低温” 或 “高温”)。
②其他条件相同,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度 的变化如图所示。

在600℃时催化效果最好的是________________(填催化剂的化学式)。c点氨气的转化率高于b点, 原因是________________。
(3)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入到如图所示的电解池(电极为惰性材料)进行电解除去NH3,净化污水。该净化过程分两步:第一步电解产生氧化剂,第二步氧化剂氧化氨氮物质生成N2。
①写出电解时A极的电极反应式:________________。
②写出第二步反应的化学方程式:__________________。
除去括号内的杂质,写出所加试剂的化学式
(1)Cl-(SO42-):(2)SO42-(CO32-):(3)Fe2+(Cu2+):
用于分离或提纯物质的方法有:A蒸馏(分馏);B萃取;C过滤;D重结晶;E分液。下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)淀粉液中含有泥沙;
(2)分离四氯化碳与水的混合物;
(3)分离汽油和煤油;
(4)分离碘水中的碘单质;
(5)KNO3晶体中含有少量食盐。
下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。請根据此表,结合学过的化学知识,回答下列问题:
| 配料表 |
精制海盐、碘酸钾(KIO3) |
| 含碘量 |
20―40mg/kg |
| 储藏方法 |
密封避光、防潮 |
| 食用方法 |
烹调时待食品熟后加入碘盐 |
据物质分类中的树状分类法有关知识,在①HIO3;②碘酸钠;③KOH;④I2O5;⑤NaCl五种均属于(填“混合物”或“化合物”或“盐”或“氧化物”),其中与碘酸钾(KIO3)属于同类物质的有(填序号)。
(2)推测出碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)溶于水(填“能”或“不能”),化学性质:碘酸钾(KIO3)在受热时。
(1)某化学兴趣小组要完成反应热的测定。实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌器、0.50mol· L-1盐酸、0.50mol· L-1NaOH溶液,实验尚缺少的玻璃用品是_____________、_______________。
(2)已知2molCO气体完全燃烧生成CO2 气体放出566 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 molCH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。写出用标准燃烧热作为反应热的CO燃烧的热化学方程式__________________。
若1 molCH4气体完全燃烧生成CO2固体和液态水,放出热量_____890 kJ( 填“>”、 “<”、“=”)。若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)的的取值范围是________________。
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: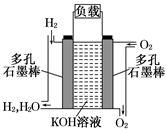
(1) 写出氢氧燃料电池工作时正极电极反应方程式:
___________。
(2)如果该氢氧燃料电池每转移0.1mol电子,消耗标准状况下_______L氧气。
(3) 若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为_______。电池总离子反应方程式为___________________________。