(1)某化学兴趣小组要完成反应热的测定。实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌器、0.50mol· L-1盐酸、0.50mol· L-1NaOH溶液,实验尚缺少的玻璃用品是_____________、_______________。
(2)已知2molCO气体完全燃烧生成CO2 气体放出566 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 molCH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。写出用标准燃烧热作为反应热的CO燃烧的热化学方程式__________________。
若1 molCH4气体完全燃烧生成CO2固体和液态水,放出热量_____890 kJ( 填“>”、 “<”、“=”)。若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)的的取值范围是________________。
已知某元素的原子序数是26,试推测:
(1)该元素的简化电子排布式为;
(2)该元素处在周期族;
(3)该元素的常见化合价是。
某同学取一定量的Al和Fe固体混合物,与2.0 L极稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题: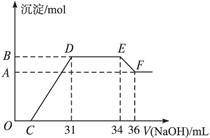
1、图中OC段没有沉淀生成,此阶段发生反应的离子方程式为。
在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为;上述现象说明溶液中______________结合OH-的能力比___________强(填写离子符号)。
2、B与A的差值为______________mol。
3、B点对应的沉淀的物质的量为____________mol,C点对应的氢氧化钠溶液的体积为______________mL。
4、求原硝酸溶液的物质的量浓度?
由苯合成香料K和解热镇痛药物G的路线如下: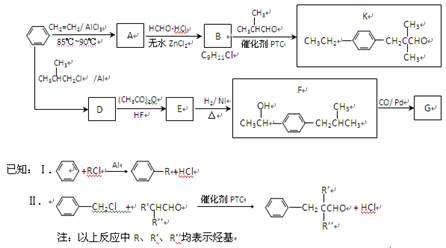
请回答:
1、芳香烃A中C、H原子数之比是4∶5,1 mol A在氧气中完全燃烧生成8 mol CO2,
A的分子式是; A的结构简式是。
2、B→K的反应类型是。
3、B的结构简式是。
4、D→E反应的化学方程式是。
5、K与新制Cu(OH)2悬浊液反应的化学方程式是。
6、G与第55小题中反应的有机产物互为同分异构体,含有相同的官能团,且位置与F中官能团的位置相同,G的结构简式是。
由中国科研人员从中药材中提取的金丝桃素对人工感染的H5N1亚型禽流感家禽活体具有100%的治愈率。根据下面金丝桃素的结构简式回答下列问题: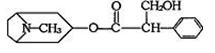
1、金丝桃素能在NaOH水溶液中加热反应得A和B,B为芳香族化合物,写出B的结构简式:B:,A的分子式是
2、室温下,B用稀盐酸酸化得C,下列物质中不能和C发生反应的是(填序号)
①浓H2SO4和HNO3的混合②H2(催化剂加热)③CH3CH2CH2CH3④Na
⑤O2(催化剂)⑥NaHCO3溶液
3、写出两分子C与浓H2SO4共热,生成八元环状物的化学方程式:
。
4、写出符合下列条件的与C互为同分异构体是。(任写一种)
①能发生银镜反应②苯环上的一卤代物有3种③1mol该有机物与足量金属钠反应产生1mol气体
三聚氰胺(化学式:C3N6H6)是一种非食品类的重要有机化工原料,广泛用于塑料、造纸、建材等行业。下图是我国科技工作者研制的以尿素为原料生产三聚氰胺的工艺——“常压气相一步法联产纯碱新技术”: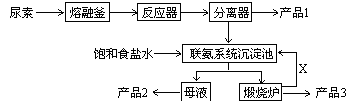
已知:①尿素的熔点是132.7℃,常压下超过160℃即可分解;
②三聚氰胺的熔点是354℃,加热易升华,微溶于水;
③以尿素为原料生产三聚氰胺的原理是:6 CO(NH2)2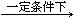 C3N6H6 +6 NH3 + 3 CO2
C3N6H6 +6 NH3 + 3 CO2
请回答:
1、尿素是一种常用含氮量最高的化肥,其氮元素的质量百分数为,在实验室使其熔化的容器名称叫_________ 。
2、工业上合成尿素的化学反应方程式为___________________________(反应条件可以不写)
3、写出各主要成份的化学式:产品1、产品2、X
4、联氨系统沉淀池中发生的化学反应方程式为:;
5、为了使母液中析出更多的产品2 ,常用的方法是
| A.加入固体NaCl | B.加入固体NaHCO3 | C.通入CO2气体 | D.通入NH3 |
6、若生产过程中有4%的尿素损耗,每吨尿素可生产三聚氰胺吨,
副产品纯碱吨。(精确到0.001)