(共11分)西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关理化性质如下表所示: 
| 分子式 |
结构简式 |
外观 |
熔点 |
溶解性 |
| C12H10ClN3O |
白色结晶粉末 |
170~172°C |
易溶于水 |
(1)氯元素基态原子核外电子的未成对电子数为 。
(2)氯吡苯脲的晶体类型为_______ ,所含第二周期元素第一电离能从大到小的顺序为__________________。
(3)氯吡苯脲晶体中,氮原子的杂化轨道类型为______ _。
(4)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。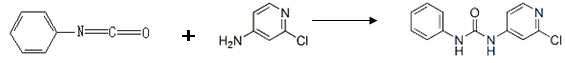
反应过程中,每生成1mol氯吡苯脲,断裂_______个σ键、断裂_______个π键
(5)波尔多液为常见杀菌剂,喷洒后生成可溶的硫酸铜溶液,加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成深蓝色透明溶液,得到配位数为4的的配合物。写出沉淀溶解的离子方程式 。
根据下列叙述写出相应的热化学方程式:
(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,该反应的热化学方程式是。
(2)如图是198K时N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式为:。
(3)写出以下物质的电离方程式:
NaHCO3;
CH3COONH4;
H2CO3
I.在标准状况下,由CO和CO2组成的混合气体4.48L,质量是8g。此混合物中CO和CO2的物质的量比是 ①,CO的体积分数是 ②,CO的质量分数是 ③,混合气体中C和O的原子个数比是 ④,混合气体的平均摩尔质量是 ⑤。
II.现有mg某气体,它由双原子分子构成,它的摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为________个。
(2)该气体若溶于1L水中(不考虑反应),设溶液的密度为ρg/cm3,则该溶液的物质的量浓度为__________mol·L-1。
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其中沉淀1和沉淀3为白色,沉淀2为蓝色。流程如右图:
(1)沉淀的化学式:沉淀1,沉淀2,沉淀3;
(2)写出混合液+A反应的离子方程式;
溶液+B反应的离子方程式;
有机物A可以通过不同的反应得到B和C:
(1)A的分子式为,C的含氧官能团名称为。
(2)A制取B的有机反应类型为;
A制取C的化学方程式为:。
(3)A发生消去反应后产物的结构简式为,
A分子中一定共面的碳原子有个。
(6分)已知在同一碳原子上连有两个羟基的化合物是极不稳定的,它要自动失水生成含醛基的化合物。今在无其他氧化剂存在的条件下,以甲苯和氯气为主要原料按下列过程制取苯甲醛(C6H5CHO)。
(1)条件2中试剂为_______________________。
(2)写出苯甲醛与新制Cu(OH)2悬浊液反应的化学方程式:_______________。
(3)苯甲醛在强碱性条件下可发生自身氧化还原反应,即部分氧化成羧酸盐A,部分还原成醇B。写出A经酸化后的产物苯甲酸与B酯化反应可生成一种新的化合物C的结构简式:______________________。