研究下表信息可直接得出的结论是
| 元素 |
F |
Cl |
Br |
I |
||||
| 氢化物组成 |
HF |
HCl |
HBr |
HI |
||||
| 氢化物形成难易程度 |
H2、F2混合,冷暗处剧烈化合并发生爆炸 |
H2、Cl2混合,光照或点燃时发生爆炸 |
H2与Br2混合,加热发生化合 |
H2、I2混合,加热化合,同时又分解 |
||||
| 氢化物热稳定性 |
很稳定 |
稳定 |
较稳定 |
较不稳定
|
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g) 2SO3(g)∆H=-196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g)∆H=-196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
| 反应时间/min |
n(SO2)/mol |
n(O2)/mol |
| 0 |
2 |
1 |
| 5 |
1.2 |
|
| 10 |
0.4 |
|
| 15 |
0.8 |
下列说法不正确的是
A.反应在前5min的平均速率为v (SO2)=0.08mol·L−1 ·min−1
B.保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C.该温度,反应的平衡常数为11.25L·mol-1
D.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知: 3I2+6OH—==IO3—+5I—+3H2O,下列说法不正确的是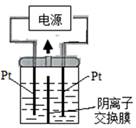
| A.右侧发生的电极方程式:2H2O+2e—==H2↑+2OH— |
| B.电解结束时,右侧溶液中含有IO3— |
| C.电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑ |
| D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 |
下列溶液中粒子的物质的量浓度关系正确的是
| A.0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B.20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L盐酸混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
| A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B.简单离子的半径:X > Z > M |
| C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z单质能从M与R元素构成的盐溶液中置换出单质M |
下列实验可实现鉴别目的是
| A.用KOH溶液鉴别SO3(g)和SO2 |
| B.用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 |
| C.用CO2鉴别NaAlO2溶液和CH3COONa溶液 |
| D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 |