下图甲表示春季晴天某密闭大棚内一昼夜CO2浓度的变化。乙图曲线a表示某种植物在20℃、CO2浓度为0.03%的环境中随着光强度的变化光合作用合成量的变化;在b点时改变某种条件,结果发生了如曲线b的变化。请分析回答。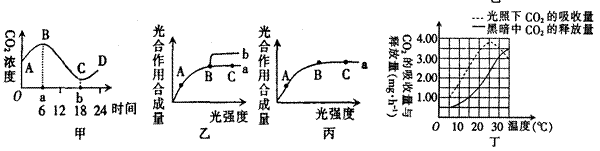
(1)甲图中,一昼夜中CO2浓度最高和最低的时间点分别是a时和b时,在这两个时间点植
物光合作用强度 (填大于、等于或小于)呼吸作用强度。
(2)分析乙图在B点时改变的某种条件可能是(列举一种情况即可):
可能的条件: 。
理由: 。
(3)丁图中在5℃时光合作用制造的有机物量是呼吸消耗有机物量的 倍。
(4)乙图中A点与B点相比较,A点时叶绿体中NADPH的含量 (填“多”或“少”),乙图如果在A、C点时温度分别降低10℃,则曲线有何变化?请在丙图中表示出来。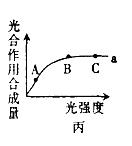
(5)某学校研究小组为了研究浇灌蔬菜大棚的水质污染情况,进行了微核实验。微核由染色体的断片或整条染色体形成,是真核细胞中的一种异常结构,呈圆形或椭圆形,游离于主核之外。微核往往由于细胞受辐射或化学药物的作用而产生,“微核检测”可用于了解化学物质的遗传毒性。
该小组的同学采集了蔬菜大棚浇灌水为母液,用蒸馏水稀释,配制了一系列浓度的溶液,各取等量加入烧杯A、B、C、D中;另取等量蒸馏水加入烧杯E,之后,将5个大小和生长状况相同、幼根已培养至1 cm的洋葱,分别置于上述5种溶液中培养24h,然后再将洋葱转移到蒸馏水中继续培养24h。24h后从每个洋葱上随机取4条根尖并按常规方法制作临时装片,在显微镜下观察每个装片上的1000个根尖细胞,计算其中出现微核的细胞数目(微核的千分率),结果如下表所示。
| 母液/蒸馏水 |
细胞微核率(‰) |
b |
||||
| A |
1/5 |
12.54 |
13.50 |
11.72 |
13.00 |
|
| B |
2/5 |
15.92 |
15.00 |
14.85 |
14.91 |
|
| C |
3/5 |
18.68 |
16.22 |
17.00 |
18.00 |
|
| D |
5/5 |
20.12 |
20.20 |
21.00 |
18.96 |
|
| E |
蒸馏水 |
3.43 |
3.00 |
3.64 |
3.56 |
|
请分析回答:
①观察微核的时候,要镜检处于细胞分裂 期的细胞
②表中b应该表示 ,E组的目的是 ,该实验可得出什么结论?
将燕麦幼苗的胚根尖端及胚芽尖端各切去4mm,再将剩余10 mm的胚根及胚芽每10
条一组分别放入不同浓度的生长素溶液中,保持在25℃下培养2 d,实验结果如下表:
| 生长素溶液浓度(mol/L) |
10-13 |
10-12 |
10-11 |
10-10 |
10-9 |
10-8 |
10-7 |
10-6 |
10-5 |
10-4 |
|
| 2d后平均长度(mm) |
胚芽 |
12.3 |
12.3 |
12.7 |
13.5 |
14.7 |
16.0 |
15.1 |
12.2 |
10.8 |
10.0 |
| 胚根 |
11.3 |
12.1 |
12.7 |
13.6 |
12.6 |
12.0 |
10.9 |
10.0 |
10.0 |
10.0 |
(1)实验中盛有不同浓度生长素溶液的小培养皿必须加盖,其原因是____________。 切去胚芽尖端及胚根尖端的主要原因是______。
(2)根据实验数据可以得知:与胚芽相比,胚根对生长素的敏感程度较________。
(3)某同学用切去尖端的胚芽作为实验材料验证生长素(IAA)与赤霉素(GA)对胚芽生长的促进作用,实验结果如下图曲线所示。从图中判断,该同学的实验结果能不能准确说明生长素与赤霉素对胚芽的生长有共同促进作用?________,其主要原因是___________。
根据下图回答有关问题:
(1)内环境主要是由、和等组成的,是细胞赖以生存的液体环境。
(2)细胞与内环境直接交换的④为,⑤为。
(3)用简明短语表述⑥。
珠江三角洲的农民充分利用自然条件,建立该地特有的农业生态系统的良性循环模式:蔗基、鱼塘和桑基、鱼塘。下图是蔗基、鱼塘和桑基、鱼塘的模式图,据图回答下列问题:
(1)这种人工生态系统最基本的生物因素是_________。要使它长期稳定发展,除了有稳定的________来源,各类生物要_______。
(2)建立这一生态系统的目的是使生产者固定的能量__________;其能量利用率高的原因是其在营养结构具有_________的特点。
(3)蚕粪、蔗叶进入鱼塘经过________的作用,释放出_________,被植物利用。
(4)概括地说,该生态系统功能的维持,取决于____。
(5)该生态系统把桑基鱼塘与蔗基鱼塘有机地组合在一起,优化了系统结构,遵循___ 原理。
为了大力发展我国的肉牛和奶牛养殖业,科学家们在育种途径上进行了大胆探索,并取得了初步成果。
Ⅰ.2002年1月中旬到2月中旬,中国自主完成的首批成年体细胞克隆牛在山东曹县五里墩陆续降生。克隆牛有3个母亲,A牛提供细胞核即供体细胞,B牛提供去除细胞核的卵细胞即受体细胞,两种细胞在电脉冲的刺激下融合之后,通过细胞分裂形成早期胚胎,再将这个胚胎植入C牛子宫内。请回答下列问题:
(1)培育出的克隆牛几乎就是_牛复制品,这是因为控制牛性状遗传的物质主要存在
于中。
(2)克隆牛的培育成功说明了__。
Ⅱ.在克隆技术出现之前,育种工作者已经开始采用胚胎分割移植方法来尽快繁育更多的优质牛。这种育种技术的主要步骤是:将经过人工受精得到的受精卵在试管内培养到8个细胞的胚胎时,进行胚胎分割,均分为4份,再分别移植到多头母牛的子宫内发育、分娩,就能得到多头所需要的小牛。
(3)胚胎分割移植要在受精卵培养到8个细胞的卵裂期时进行,其主要原因是:__。
(4)通过胚胎分割移植培育出的这些小牛,其性别表现为__。
| A.雌雄的可能性各占50% | B.全为雌性或全为雄性 |
| C.全为雌性 | D.全为雄性 |
1997年英国科学家培育的世界上第一只克隆绵羊“多利”的程序为下图所示,据图回答下列问题: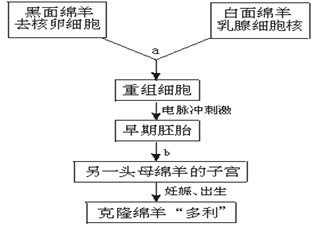
(1)写出图中a、b所指的细胞工程名称:a.___________,b.___________。
(2)对重组细胞进行电脉冲刺激的目的是________________________________。
(3)实施细胞工程a时,所需的受体细胞大多采用动物卵细胞的原因是。
(4)“多利”面部的毛色是___________。请根据遗传学原理说明判断依据是_________________________。
(5)继植物组织培养之后,克隆绵羊的培育成功,证明动物细胞也具有____________。
(6)请举一例,说明克隆绵羊培育成功的实际意义:_____________________。