下列离子方程式中,不正确的是 ( )
| A.向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| B.向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全 2Ba2++4OH-+Al3++2SO42- |
| C.向Mg(HCO3)2溶液中加入过量的 NaOH溶液 Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O |
| D.向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3- |
下列过程中,最终的白色沉淀不一定是BaSO4的是 
某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是
A.K+、Na+、HCO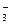 、NO 、NO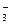 |
B.Na+、SO 、Cl—、ClO— 、Cl—、ClO— |
C.H+、Mg2+、SO 、NO 、NO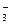 |
D.Ag+、K+、NO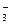 、Na+ 、Na+ |
盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。
已知 H2O(g)=H2O(l);△H1=Q1 kJ/mol
C2H5OH(g)=C2H5OH(l);△H2=Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H3=Q3 kJ/mol
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
| A.Q1+Q2+Q3 | B.0.5(Q1+Q2+Q3) |
| C.1.5Q1-0.5Q2+0.5Q3 | D.0.5Q1-1.5Q2+0.5Q3 |
下列关于浓硫酸的叙述正确的是
| A.浓硫酸具有吸水性,因而能使蔗糖炭化 |
| B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 |
| C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 |
| D.浓硫酸在常温下能够使铁、铝等金属钝化 |
.据报道,全球每年发生金属腐蚀而造成的直接经济损失达数千亿美元。下列各电极反应式中,能表示铁的电化学腐蚀的是
①Fe-2e-=Fe2+②2H++2e-=H2↑③Fe-3e-=Fe3+ ④2H2O+O2+4e-=4OH-⑤4OH--4e-=2H2O+O2↑
④2H2O+O2+4e-=4OH-⑤4OH--4e-=2H2O+O2↑
| A.①②⑤ | B.②③④ | C.①②④ | D.①③⑤ |