一些烷烃的燃烧热如下表:
| 化合物 |
燃烧热/kJ·mol-1 |
化合物 |
燃烧热/kJ·mol-1 |
| 甲烷 |
891.0 |
正丁烷 |
2878.0 |
| 乙烷 |
1560.8 |
异丁烷 |
2869.6 |
| 丙烷 |
2221.5 |
异戊烷 |
3531.3 |
下列表达正确的是 
| A.正戊烷的燃烧热大于3531.3kJ·mol-1 |
| B.稳定性:正丁烷>异丁烷 |
| C.乙烷燃烧的热化学方程式为: 2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ;△H= -1560.8 kJ·mol-1 |
| D.相同物质的量的烷烃CnH2n+2,n越大,燃烧放出的热量越多 |
下列反应的化学方程式不正确的是( )
| A.CH2===CH2+HBr―→CH3—CH2—Br |
B.CH4+Cl2 CH3Cl+HCl CH3Cl+HCl |
C.2CH3Cl+2NaOH CH2===CH2+2NaCl+2H2O CH2===CH2+2NaCl+2H2O |
D.CH3Cl+NaOH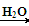 CH3OH+NaCl CH3OH+NaCl |
冰箱制冷剂氟氯甲烷在高空受紫外线辐射时产生Cl原子,并能发生下列反应:Cl·+O3―→ClO·+O2 ClO·+O·―→Cl·+O2,从而引发损耗臭氧的反应.下列说法不正确的是( )
| A.反应后O3将变成O2 |
| B.Cl原子是反应的催化剂 |
| C.氟氯甲烷是反应的催化剂 |
| D.Cl原子反复起分解O3的作用 |
1溴丙烷( )和2溴丙烷 (
)和2溴丙烷 ( )分别与NaOH的乙醇溶液共热的反应中,两反应( )
)分别与NaOH的乙醇溶液共热的反应中,两反应( )
| A.产物相同,反应类型相同 |
| B.产物不同,反应类型不同 |
| C.碳氢键断裂的位置相同 |
| D.碳溴键断裂的位置相同 |
下列反应中属于水解反应的是( )
A.CH4+Cl2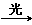 CH3Cl+HCl CH3Cl+HCl |
| B.CH≡CH+HCl―→CH2===CHCl |
C.CH3CH2Br+NaOH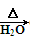 CH3CH2OH+NaBr CH3CH2OH+NaBr |
D.CH3CH2Br+NaOH CH2===CH2↑+NaBr+H2O CH2===CH2↑+NaBr+H2O |
有关溴乙烷的下列叙述中,正确的是( )
| A.在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成 |
| B.溴乙烷不溶于水,能溶于大多数有机溶剂 |
| C.溴乙烷与NaOH的醇溶液反应,可生成乙醇 |
| D.溴乙烷通常用溴与乙烷直接反应来制取 |