将1molCO和1molH2O充入某固定容积的反应器中,在某条件下达到平衡:
CO+H2O(g)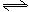 CO2+H2,此时有2/3的CO转化为CO2。
CO2+H2,此时有2/3的CO转化为CO2。
(1)该平衡混合物中CO2的体积分数为
(2)若容器体积为1L,到达平衡所需时间为2分钟,则H2的平均反应速率为
(3)若在相同条件下,向容器中充入1molCO2、1molH2和1molH2O,则达到平衡时与⑴中平衡相比较,平衡应向 (填“正反应方向”、“逆反应方向”或“不”)移动,此时平衡混合物中CO2的体积分数可能是下列各值中的
| A.22.2% | B.27.55% | C.33.3% | D.36.8% |
(4)结合(3)中计算结果分析若平衡向正方向移动时,则下列说法中正确的是( )
①生成物的产量一定增加; ②生成物的体积分数一定增加;
③反应物的转化率一定增大; ④反应物的浓度一定降低;
⑤正反应速率一定大于逆反应速率; ⑥一定使用了催化剂.
某有机物10.8g完全燃烧生成7.2g水和15.68L(标准状况)二氧化碳,0.25mol此有机物质量为27g
(1)此有机物的分子式为。
(2)又知此有机物有弱酸性,能与金属钠反应,也能与氢氧化钠溶液反应,试推断此有机物的结构,写出可能的结构简式。
快乐是什么?精神病学专家通过实验发现:在大脑的相应部位—“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态。人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。多巴胺结构如右图: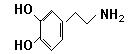
(1)多巴胺分子式: 。
(2)试判断多巴胺能发生的化学反应()
| A.加成 | B.取代 | C.氧化 | D.水解 |
(3)写出与多巴胺互为同分异构体且符合下列条件的物质的结构简式:
(a)属于1、3、5三取代苯(b)苯环上直接连有一个羟基和一个氨基
(c)分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2︰1。
、 。
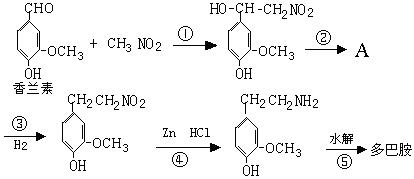
(4)多巴胺可由香兰素与硝基甲烷缩合,再经锌汞齐还原水解而得。合成过程表示如下:
|
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有 某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 |
乙醛 |
乙酸 |
甘油 |
乙二醇 |
水 |
| 沸点 |
20. 8℃ 8℃ |
117.9℃ |
290℃ |
197.2℃ |
100℃ |
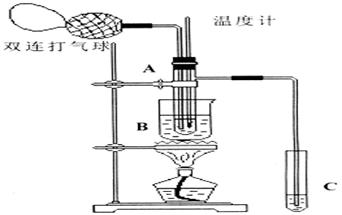
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________;目的是____________________;当试管A内的主要反应完成后温度计水银球的位置应在____________,目的是_______________________;
(3)烧杯B的作用是_ __________________________;烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找);
__________________________;烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找);
质谱图表明某有机物的相对分子质量为70,红外光谱表征到C==C和C==O的存在, 核磁共振谱如下图(峰面积之比依次为1:1:1:3);分析核磁共振谱图,回答下列问题:
核磁共振谱如下图(峰面积之比依次为1:1:1:3);分析核磁共振谱图,回答下列问题:
(1)分子中共有种化学环境不同的氛原子。
(2)该物质的分子式为
(3)该有机物的结构简式为。
下列实验操作或叙述正确的是___________(填序号)
| A.乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇 |
| B.将无水乙醇和浓硫酸按体积比3∶1混合,加热至140℃制取乙烯 |
| C.蔗糖水解用浓硫酸作催化剂 |
| D.在鸡蛋白溶液中加入浓HNO3,微热后会生成黄色物质 |
E.油脂皂化反应后,反应混合物中加入食盐可将肥皂分离出来
F.植物油和裂化汽油可用溴水鉴别