右图曲线a表示放热反应
X(g) + Y(g)  Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是 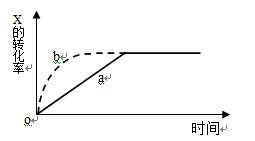
| A.升高温度 | B.加大X的投入量 |
| C.加催化剂 | D.增大体积 |
不洁净玻璃仪器洗涤方法正确的是
| A.做银镜反应后的试管用氨水洗涤 | B.做碘升华实验后的烧杯用酒精洗涤 |
| C.盛装苯酚后的试管用盐酸洗涤 | D.做酯化反应后的试管用饱和Na2CO3溶液洗涤 |
为了证明甲酸溶液中含有甲醛,正确的操作是
| A.滴入石蕊试液 | B.加入金属钠 |
| C.加入银氨溶液(微热) | D.加入氢氧化钠溶液后加热蒸馏,在馏出物中加入银氨溶液(微热) |
扑热息痛是一种优良的解热镇痛药,其结构为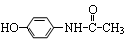 ,则有关它的性质错误的是
,则有关它的性质错误的是
| A.与氢氧化钠溶液共热消耗2molNaOH / mol | B.能与浓溴水发生取代反应 |
| C.不能使酸性高锰酸钾溶液褪色 | D.遇三氯化铁溶液呈现紫色 |
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图。下列叙述正确的是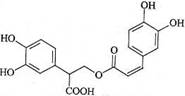
| A.迷迭香酸属于芳香烃 |
| B.迷迭香酸可以发生水解反应、取代反应和酯化反应 |
| C.1mol迷迭香酸最多能和9mol氢气发生加成反应 |
| D.1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应 |
下列实验能成功的是
| A.苯与浓溴水反应(Fe作催化剂)制溴苯 |
| B.乙醇、冰醋酸、稀硫酸共热制乙酸乙酯 |
| C.氯乙烯加聚后的生成物使酸性KMnO4溶液褪色 |
| D.甲酸甲酯能使新制Cu(OH)2在加热条件下产生红色沉淀 |