下列溶液中粒子的物质的量浓度关系正确的是
| A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B.20ml0.1mol/LCH3COONa溶液与10ml0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
化学反应C(s)+H2O(g)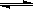 CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是()
CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是()
| A.加入水蒸气使容器压强增大,平衡向逆反应方向移动 |
| B.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| C.减小压强,平衡向正反应方向移动 |
| D.加入固体碳,平衡向正反应方向移动 |
下列各组热化学方程式程中,△H的绝对值前者大于后者的是()
①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(g)+1/2O2(g)=H2O(g);△H5 2H2(g)+O2(g)=2H2O(l);△H6
| A.① | B.② | C.②③ | D.①②③ |
反应3Fe(s)+4H2O(g)  Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是()
Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是()
| A.保持体积不变,充入Ne使体系压强增大 | B.将容器的体积缩小一半 |
| C.压强不变,充入Ne使容器的体积增大 | D.保持体积不变,充入水蒸汽 |
对于可逆反应H2(g)+I2(g) 2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是()
2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是()
| A.H2(g)的消耗速率与HI(g)的生成速率比为2:1 |
| B.达平衡前,反应进行的净速率是正、逆反应速率之差 |
| C.达平衡前,正、逆反应速率的比值是恒定的 |
| D.达到平衡时,表示反应已经停止。 |
利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是()
| A.电解时以纯铜作阳极 |
| B.电解时阴极发生氧化反应 |
| C.粗铜连接电源负极,其电极反应是Cu-2e— =Cu2+ |
| D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥 |