1.t℃时,某稀硫酸溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b="13" :(1)该温度下水的离子积常数K w的数值为 。
(2)该温度下(t℃),将100mL 0.1 mol·L-1的稀H2SO4溶液与100mL 0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH= 。(写出计算过程)
(3)常温下pH=5的H2SO4的溶液稀释500倍后,溶液中SO42-的浓度与H+浓度的比值约为 (写出计算过程)
(1) 常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-) / c(H+)=1×10-8。
①常温下,0.1 mol·L-1 HA溶液的pH=;写出该酸(HA)与NaOH溶液反应的离子方程式:;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:。
(2) 常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH14-a(>、<、=)
(3) 向物质的量浓度均为0.01mol·L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+)。(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
(4)设Ka、Kh、Kw分别表示CH3COOH的电离平衡常数、CH3COO-的水解平衡常数和水的离子积常数,则三者之间的关系为:
(1)H2S的燃烧热ΔH= -a kJ·mol-1,则H2S燃烧反应的热化学方程式为。
(2)已知:高温下,在密闭容器中用H2还原WO2可得到金属钨。当温度过高时,WO2(s)会转变为WO2 (g)。请根据以下反应:
WO2 (s) + 2H2 (g)  W (s) + 2H2O (g);ΔH= +66.0 kJ· mol-1
W (s) + 2H2O (g);ΔH= +66.0 kJ· mol-1
WO2 (g) + 2H2 W (s) + 2H2O (g);ΔH = -137.9 kJ· mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ· mol-1
计算出WO2 (s)  WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。
(3)工业上常利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,反应的化学方程式为:
CH4 + CO2 =" 2CO" + 2H2
已知CH4、H2和CO的燃烧热分别为890.3 kJ·mol-1、285.8 kJ·mol-1、283.0 kJ· mol-1,则生成1 m3(标准状况)CO所需热量为;
含有硫的化合物在工业生产中应用广泛,回答下列问题:
(1)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2。
①测得某黄铜矿(CuFeS2)中含硫20%(质量分数),求该矿石含铜的质量分数。
②现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:称取
研细的黄铜矿样品1.150g,在空气中进行煅烧,生成Cu、Fe3O4和SO2气体,用100 mL滴有淀粉的
蒸馏水全部吸收SO2,然后取10mL吸收液,用0.05mol/L标准碘溶液进行滴定,用去标准碘溶液的体
积为20.00mL。求该黄铜矿的纯度。
(2)将FeS和Fe2O3的混和物56.6 g,用足量稀H2SO4溶解后可得3.2 g硫,原混和物中FeS的质量。
(3)一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧
化钠溶液吸收。利用下图装置加热无水硫酸铜粉末直至完全分解。若无水硫酸铜粉末质量为10.0 g,
完全分解后,各装置的质量变化关系如下表所示。
| 装置 |
A(试管+粉末) |
B |
C |
| 反应前 |
42.0 g |
75.0 g |
140.0 g |
| 反应后 |
37.0 g |
79.0 g |
140.5 g |
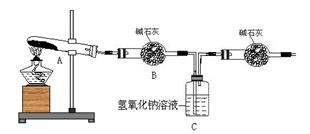
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式。
(4)硫化钠是用于皮革的重要化学试剂,可用无水Na2SO4与炭粉在高温下反应制得,化学方程式如下:
①Na2SO4 + 4C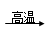 Na2S + 4CO↑②Na2SO4 + 4CO
Na2S + 4CO↑②Na2SO4 + 4CO Na2S + 4CO2
Na2S + 4CO2
a.若在反应过程中,产生CO和CO2混合气体为2mol,求生成Na2S的物质的量。
b.硫化钠晶体放置在空气中,会缓慢氧化成Na2SO3,甚至是Na2SO4,现将43.72g部分变质的硫化钠样品溶于水中,加入足量盐酸后,过滤得4.8g沉淀和1.12L H2S 气体(标准状况,假设溶液中气体全部逸出),在滤液中加入足量的BaCl2后过滤得2.33g沉淀,分析该硫化钠样品的成分及其物质的量。
硫有多种化合物,许多含硫化合物在工业上有重要的用途。
(1)工业上可用黄铁矿、焦炭在有限的空气中燃烧制备硫磺。
3FeS2 + 12C+ 8O2  Fe3O4 + nA↑+ 6S
Fe3O4 + nA↑+ 6S
A是(写化学式)。若得到192克的硫磺,则产生标准状况下的A气体L。
(2)硫的氯化物常做橡胶工业的硫化剂。硫与氯气在一定条件下反应,得到两种硫的氯化物B和D。B物质中的含硫量为0.3107,D物质中的含氯量为0.5259,B的相对分子质量比D小32。计算确定这两种氯化物的分子式分别为。
(3)硫化氢有毒。在120℃、101kPa,将H2S和O2在密闭容器中点燃,充分反应后又恢复到了原来的温度和压强时,气体体积减少30%,求原混合其气体中H2S的体积分数。写出推导过程。(不考虑硫化氢的分解)
(4)硫代硫酸钠是重要的还原剂,可用亚硫酸钠和硫粉在水溶液中加热制得。取15.12g Na2SO3溶于80.0mL水中,加入5.00g硫粉,用小火加热至微沸,反应约1小时后过滤,将滤液蒸发至体积为30.0mL,再冷却到10℃,则理论上析出Na2S2O3∙5H2O多少克?写出推导过程。(已知:Na2S2O3的溶解度,10℃时为60.0g/100g水,100℃时为207g/100g水。100℃时,Na2S2O3饱和溶液的密度为1.14g/mL)。
如图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的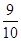 ,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)
,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)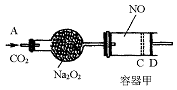
已知: 2Na2O2 + 2CO2 → 2Na2CO3 + O2
(1)已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g。
①此时,通入标准状况下的CO2气体多少L?
②容器甲中NO2转化为N2O4的转化率是多少?
③活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处.则a值必0.01(填大于、小于、等于),其理由是。
(2)若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入的量CO2,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量最小值应大于________g。