设NA为阿伏伽德罗常数,下列叙述正确的是 ( )
| A.24g镁原子的最外层电子数为NA | B.1L0.1mol·L-1乙酸溶液中H+数为0.1NA |
| C.1mol甲烷分子所含质子数为10NA | D.标准状况下,22.4L己烯的分子数为NA |
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是()
| A.CaO2具有氧化性,对面粉可能具有增白作用 |
| B.CaO2中阴阳离子的个数比为1:1 |
| C.CaO2和水反应时,每产生1 mol O2转移电子4 mol |
| D.CaO2和CO2反应的化学方程式为:2CaO2+2CO2="=2" Ca CO3+O2 |
分类法在化学的发展中起到非常重要的作用,下列分类标准合理的是()
①根据氧化物的组成元素将氧化物分成酸性氧化物、碱性氧化物和两性氧化物
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否有丁达尔效应将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学反应分为放热反应和吸热反应
⑤根据水溶液能否导电将化合物分为电解质和非电解质
| A.②④⑤ | B.②④ | C.①③⑤ | D.①②④⑤ |
下列说法正确的是
①标准状况下,22.4 L己烯含有的分子数为6.02×1023
②标准状况下,a L的氧气和氮气的混合物含有的分子数约为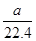 ×6.02×1023
×6.02×1023
③7.1 g氯气与足量的氢氧化钠溶液反应转移的电子数约为0.2×6.02×1023
④1 mol乙醇中含有的共价键数约为7×6.02×1023
⑤500 mL 1 mol/L的硫酸铝溶液中含有的硫酸根离子数约为1.5×6.02×1023
| A.①④ | B.②⑤ | C.③④ | D.②④ |
2008年5月我国汶川发生地震灾害,假若你是卫生防疫人员,为配制0.01 mol/L的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是
| A.取KMnO4样品时不慎在表面沾了点蒸馏水 |
| B.溶解搅拌时有液体飞溅 |
| C.定容时俯视容量瓶刻度线 |
| D.摇匀后见液面下降,再加水至刻度线 |
观察是研究物质性质的一种基本方法.一同学将一小块金属钠露置于空气中,观察到下列现象: ,
,
下列说法正确的是
| A.①发生了氧化还原反应 |
| B.②变白色是因为生成了碳酸钠 |
| C.③是碳酸钠吸收空气中的水蒸气形成了溶液 |
| D.④只发生物理变化 |