实验中的下列操作正确的是( )。
| A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B.Ba(NO3)2 溶于水,可将含有Ba(NO3)2 的废液倒入水槽中,再用水冲入下水道 |
| C.用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 |
| D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
右图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
| A.生铁块中的碳是原电池的正极 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中相同的电极反应式是:Fe-2e-=Fe2+ |
| D.a试管中发生了析氢腐蚀,b试管中发生了吸氧腐蚀 |
物质的量浓度相同(0.2 mol/L)的弱酸HX与NaX溶液等体积混合后,溶液中微粒浓度关系错误的是
| A.c(Na+)+c(H+)=c(X-)+c(OH-) |
| B.c(HX)+c(X-)=c(Na+) |
| C.若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) |
| D.若混合液呈碱性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
反应mA(固)+nB(气)  eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是
eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是
| A.达到平衡后,加入催化剂,C%不变 |
| B.该反应为放热反应 |
| C.化学方程式中m+n>e+f |
| D.达到平衡后,增加A的质量有利于平衡向右移动 |
在由水电离产生的c(H+)=1×10–14mol/L的溶液中,一定可以大量共存的离子组是
| A.NH4+、Al3+、Br–、SO42– | B.Na+、Fe2+、I–、NO3– |
| C.K+、Ba2+、Cl–、NO3– | D.K+、Na+、 I–、SO42– |
某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L。x与y的关系图所示,下列说法正确的是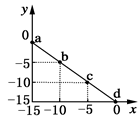
| A.该温度高于25℃ |
| B.图中a点溶液呈碱性 |
| C.该温度下,0.01 mol·L-1的HCl溶液的pH=2 |
| D.该温度下,0.01 mol·L-1的NaOH溶液的pH=12 |