根据图示填空
(1)化合物A中含氧官能团的名称是 。
(2)1mol A与2 mol H2反应生成1 mol E,其反应方程式是
___________________________________________________。
(3)B在酸性条件下与Br2反应得到D,D的结构简式是 。写出D与NaOH溶液反应的化学方程式_________________________________________。
(4)F的结构简式是 。
有以下几种物质 ①碳酸氢钠晶体;②液态氯化氢;③铁;④蔗糖;⑤乙醇;⑥熔融的K2SO4;⑦干冰;⑧石墨;⑨氨气。填空回答:(填序号)
(1)以上物质能导电的是 。
(2)以上物质中属于电解质的是 。
(3)以上物质中属于非电解质的是 。
(4)以上物质中溶于水后水溶液能导电的是。
(5)分别写出物质①、⑥在水溶液中的电离方程式。
选择下列物质分离和检验方法,将其选项填在横线上。
| A.萃取; | B.升华; | C.结晶; | D.分液;E.蒸馏;F.层析;G.过滤 |
(1)分离饱和食盐水与沙子的混合物。
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)分离水和汽油的混合物。
(4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体。
(Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题: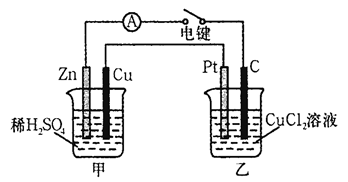
(1)甲装置的名称是____________ (填“原电池”或“电解池”)。
(2) 写出电极反应式: Pt极; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为______________。
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色___________(填“变深”、“变浅”或“无变化”)。
(Ⅱ)燃料电池是燃料(如CO、H2、CH4等)跟O2(或空气)反应,将化学能转化为电能的装置。对于以强碱为电解质的CH4燃料电池,负极电极反应式为:,随着放电的进行,溶液的pH(填“变大”“变小”或“不变”)。
(Ⅲ)由Cu2+、Cl-、Na+、SO42-四种离子中的两种离子组成的电解质溶液若干种,可选用铜电极、铂电极进行电解实验。
(1)要使电解过程中溶质的组成和质量不变,而该稀溶液的浓度增大,又无浑浊,应以_______为阳极电解溶液,阳极电极反应式为 。
(2)以铂作阳极电解溶液时,溶液的碱性有明显增强,且溶液保澄清,电解的总反应式为。
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH0,△S0(填“<,>或=”)。
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。
①在0~2min内,以H2表示的平均反应速率为mol·L-1·s-1 ,CO的转化率为。
②列式计算300℃时该反应的平衡常数K=。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容积为2L的密闭容器中,此时反应将。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是。
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图。
氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用, 
(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:。
(2)若已知下列数据:
| 化学键 |
H-H |
N≡N |
| 键能/kJ·mol-1 |
435 |
943 |
试根据表中及图中数据计算N-H的键能kJ·mol-1。
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1,E2______,
△H(填“增大”、“减小”、“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g)= 2N2(g)+6H2O(g) ;△H1=akJ·mol-1
N2(g)+O2(g)=2NO(g);△H2=bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3=kJ/mol(用含a、b的式子表示)。