反应3Cu+8HNO3 = 3Cu(NO3)2+2NO↑+4H2O 的离子方程式为:
每生成11.2L标准状况下的气体,被还原的 (填氧化剂的名称)的质量为 。
进入秋冬季节后,郑州市频现雾霾天气,给人们的出行带来极大的不便和危害,人们“谈霾色变”。目前郑州市汽车保有量达230万量,汽车尾气的污染是引起雾霾的主要因素之一,NO和CO是汽车尾气的主要污染物。
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)  SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
(2)某科研机构设计传感器检测CO的含量,其工作原理示意图如下:
Pt电极上发生的是 反应(填“氧化”或“还原”);写出NiO电极的电极反应式
(3)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,用化学方程式表示其原理
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池。其构造如图所示:两个电极均由多孔性碳制成,通入的气体由孔隙中进入,并在电极表面放电。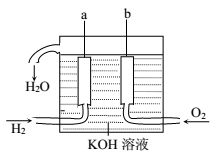
(1)a是_____________极(填正或负),b是___________极(填正或负),电极反应式分别为:a__________________,b_______________。
(2)下图是一个化学过程的示意图。已知甲池的总反应式为: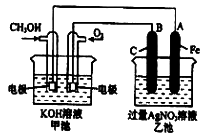
2CH3OH+3O2+4KOH=2K2CO3+6H2O
①请回答:甲池是 装置,B(石墨)电极的名称是 。
②写出下列电极反应式:通入CH3OH的电极的电极反应式是 ,A(Fe)电极的电极反应式为 。
③乙池中反应的化学方程式为 。
④当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上转移电子 mol。
在101kPa时,H2在1molO2中完全燃烧生成2mol液态水,放出571.6kJ的热量,H2的燃烧热为 ,表示H2燃烧热的热化学方程式为 。
写出298K常温时,下列反应的热化学方程式:
在稀溶液中1molH2SO4与足量NaOH反应放热114.6kJ,表示该中和热的热化学方程式为:
CO、CH4均为常见的可燃性气体。120℃、101 kPa下,a mL由CO、CH4组成的混合气体在bmL O2中完全燃烧后,恢复到原温度和压强。
(1)若混合气体与氧气恰好完全反应,产生bmL二氧化碳,混合气体中一氧化碳和甲烷的物质的量之比为: 。
(2)若燃烧后气体体积缩小了a/4 mL,则a与b关系的数学表示式是 。