设NA表示阿伏加德罗常数,下列叙述正确的是
| A.71 g氯气被还原得到的电子数为2NA |
| B.100 mL l mol·L-1的碳酸钠溶液中含有的CO32-数为0.1NA |
| C.标准状况下,2.24 L乙烯中含有的σ键数目为0.5 NA |
| D.用含有少量锌、铁、银等杂质的粗铜作阳极电解精炼,当阴极析出64 g金属时阳极失去的电子数小于2NA |
下列有关铁及其化合物的说法中正确的是
| A.Fe3O4是一种红棕色粉末,俗称铁红 |
| B.Fe(OH)2为白色固体,不溶于水,能在空气中稳定存在 |
| C.除去FeCl2中的FeCl3杂质,可以向溶液中加入过量铁粉,然后过滤 |
| D.检验FeCl2溶液是否变质的方法是:加入KSCN溶液,观察是否有血红色沉淀产生 |
NA代表阿伏加德常数,下列说法正确的是
A.标准状况下,22.4LCCl4含有NA个CCl4分子
B 2g氢气所含原子数目为NA
C在常温常压下,11.2L氮气所含的原子数目为NA
D 17g氨气所含电子数目为10NA
下列有关化学用语使用正确的是
A.硫原子的原子结构示意图: |
B.NH4Cl的电子式: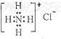 |
| C.聚乙烯使溴水因化学反应褪色 |
| D.在CS2、PCl3中各原子最外层均能达到8电子的稳定结构 |
A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不可能为
A.n+8 B.n+18 C.n+32D.n+20
由钠、镁、铝、铁中的两种或两种以上金属组成的混合物5克,加入足量的稀硫酸,若产生的氢气标准状况下体积为5.6L,则混合物中一定含有的金属是
| A.镁 | B.铝 | C.铁 | D.钠 |