常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中
| A.c(NH4+)<c(Cl-) | B.c(NH4+)=c(Cl-) |
| C.c(NH4+)>c(Cl-) | D.无法确定c(NH4+)与c(Cl-)的关系 |
下列说法不正确的是
| A.在原电池的负极和电解池的阳极上都是发生失电子的氧化反应 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.甲醇燃料电池可把化学能转化为电能 |
| D.锌锰干电池中,锌电极是负极 |
对于锌、铜和稀H2SO4组成的原电池装置中,当导线中有1 mol 电子通过时,理论上的两极变化是:①锌片溶解了32.5 g②锌片增重32.5 g③铜片上析出1 g H2④铜片上析出1 mol H2
| A.①和③ | B.①和④ | C.②和③ | D.②和④ |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是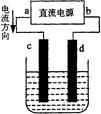
| A.a为负极、b为正极 |
| B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
分析下面的能量变化示意图,下列热化学方程式正确的是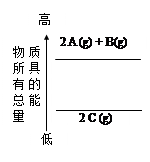
| A.2A(g)+ B(g)=2C(g);△H="a" kJ·mol-1(a>0) |
| B.2A(g)+ B(g)=2C(g);△H=akJ·mol-1(a<0) |
| C.2A + B="2" C;△H="a" kJ·mol-1(a<0) |
| D.2C="2A" +B;△H="a" kJ·mol-1(a>0) |
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
| A.加入适量的6 mol·L-1的盐酸 | B.加入数滴氯化铜溶液 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |