已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2mol·L-1HF溶液中加入1 L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是( )
| A.25℃时,0.1 mol·L-1HF溶液中pH=1 | B.Ksp(CaF2)随温度和浓度的变化而变化 |
| C.该体系中有CaF2沉淀产生 | D.加入CaCl2溶液后体系中的c(H+)浓度不变 |
X、Y、Z、W有如右图所示的转化关系,已知焓变:ΔH=ΔH1+ΔH2,则X、Y不可能是()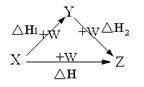
A.C、CO
B.AlCl3、Al(OH)3
C.Fe、Fe(NO3)2
D.S、SO3
下列反应所得溶液中一定只含一种溶质的是
| A.向AlCl3溶液中滴入NaOH溶液 | B.向NaOH溶液中通入SO2气体 |
| C.向稀硝酸中加入过量铁粉 | D.向Na2CO3溶液中滴入盐酸 |
若NA代表阿伏加德罗常数,下列说法正确的是()
| A.1 molCl2参加反应转移电子数一定为2NA |
| B.将31g的Na2O溶解于1L水中,所得溶液中Na+的物质的量浓度为1 mol/L |
| C.常温常压下,22.4L的NH3和16g CH4中所含有的电子数都是10NA |
| D.20g重水(2H216O)含有的电子数为10NA |
分类是化学研究中常用的方法。下列分类方法中,正确的是( )
| A.根据组成元素的种类,将纯净物分为单质和化合物 |
| B.根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等 |
| C.根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物 |
| D.根据分散系的稳定性大小,将分散系分为胶体、浊液和溶液 |
下列判断错误的是()
| A.离子半径:Na+>Mg2+>Al3+ | B.还原性:Cl->Br->I- |
| C.酸性:HClO4>H2SO4>H3PO4 | D.碱性:NaOH>Mg(OH)2>Al(OH)3 |