要除去NaCl溶液中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下四种试剂:①Na2CO3②BaCl2③NaOH④HCl。加入试剂合理的操作顺序是
| A.①②③④ | B.③①②④ | C.④②①③ | D.③②①④ |
据报道,2002年10月26日,俄罗斯特种部队在解救人质时,除使用了非致命武器芬太奴外,还使用了一种麻醉作用比吗啡强100倍的氟烷,若氟烷的化学式为C2HClBrF3,则沸点不同的上述氟烷有( )
| A.1种 | B.2种 | C.3种 | D.4种 |
C6H14的各种同分异构体中,整个分子所含甲基数和它的一氯取代物的数目下列相符的是( )
| A.2个甲基,可能生成4种一氯代物 | B.3个甲基,可能生成5种一氯代物 |
| C.3个甲基,可能生成3种一氯代物 | D.4个甲基,可能生成4种一氯代物 |
下图为元素周期表前四周期的一部分,且X、Y、Z、R和W均为主族元素。下列说法正确的是( )
| X |
|||
| Y |
Z |
R |
|
| W |
| A.五种元素的原子最外层电子数一定大于2 |
| B.五种元素一定都是非金属元素 |
| C.R的最高价氧化物对应的水化物一定是强酸 |
| D.Y的氧化物一定具有两性 |
相对分子质量为84,通过加氢反应可在分子中引入两个-CH2-原子团的不饱和烃有( )
| A.2种 | B.3种 | C.4种 | D.5种 |
科学家最近在-100℃的低温下合成一种烃X,此分子的模型如下图(图中的连线表示化学键),下列说法正确的是( )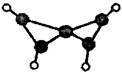
| A.X分子中在同一平面上的碳原子最多5个 |
| B.X能使溴的四氯化碳溶液褪色 |
| C.X是一种在常温下能稳定存在的液态烃 |
| D.充分燃烧等质量的X和甲烷,X消耗氧气多 |