分类方法在化学学科的发展中起到重要的作用。下列分类标准不合理的是 ( )
①根据元素原子最外层电子数的多少将元素分为金属和非金属
②根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质
③依据组成元素的种类,将纯净物分为单质和化合物
④根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
⑤根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物
⑥根据分散系的稳定性大小,将分散系分为胶体、浊液和溶液
⑦依据有无电子转移,将化学反应分为氧化还原反应和非氧化还原反应
⑧根据化学反应的热效应,将化学反应分为放热反应、吸热反应
⑨根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
| A.①④⑤⑥⑨ | B.③④⑤⑥⑧ | C.只有①③ | D.全部正确 |
分类是科学研究的重要方法,下列物质分类不正确的是
| A.化合物:冰水混合物,烧碱,小苏打 |
| B.分子晶体:干冰,硫磺,冰醋酸 |
| C.非电解质:乙醇,铜,葡萄糖 |
| D.混合物:铝热剂,纯净矿泉水,分析纯盐酸 |
下列各组有机物中,仅用溴水不能鉴别出的是
| A.苯、四氯化碳 | B.乙炔、乙烯 | C.丙炔、乙烷 | D.苯、酒精 |
核泄漏地区可检测到的放射性元素有137Cs、134Cs、131I等。下列叙述正确的是
A.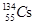 和 和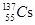 形成的单质物理性质相同 形成的单质物理性质相同 |
B.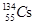 比 比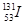 多3个中子 多3个中子 |
C.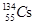 和 和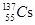 形成的单质化学性质相同 形成的单质化学性质相同 |
D.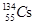 和 和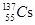 都是铯的同素异形体 都是铯的同素异形体 |
下列各组物质一定互为同系物的是
| A.苯和乙炔 | B.C3H8C4H10 | C.C3H6C5H10 | D.乙烯和丁二烯 |
化学与人类生活、社会可持续发展密切相关。下列有关叙述中不正确的是
| A.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
| B.推广碳捕集和储存技术,逐步实现二氧化碳零排放 |
| C.含有重金属的电器废品不能随意丢弃,要分类回收并利用 |
| D.煤炭燃烧过程中安装“固硫”装置,主要是为了减少二氧化硫的排放 |