氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq) + OH—(aq) 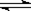 F—(aq) + H2O(l) △H=-67.7 kJ/mol
F—(aq) + H2O(l) △H=-67.7 kJ/mol
H+(aq) + OH—(aq) 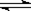 H2O(l) △H=-57.3kJ/mol
H2O(l) △H=-57.3kJ/mol
在10 mL 0.1mol/L的NaOH溶液中,加入10 mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是
| A.当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发) |
B.水电离的热化学方程式为:H2O(1) 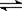 H+(aq)+OH—(aq);△H= +57.3kJ/mol H+(aq)+OH—(aq);△H= +57.3kJ/mol |
| C.当c > 0.1时,一定不存在:c(Na+) = c(F—) |
| D.若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1 |
.下列叙述中正确的是()
| A.等质量的O2、O3中所含氧原子个数之比为2:3 |
| B.标准状况下,体积相等的CCl4和Cl2,前者含有的氯原子数是后者的两倍 |
| C.1molCO和CH4的混合气体所含的碳原子数和1molCO2所含的碳原子数相等 |
| D.10g NH3中含有原子数目约为4×6.02×1023 |
将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为()
A.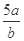 mol/L mol/L |
B. mol/L mol/L |
C. mol/L mol/L |
D. mol/L mol/L |
下列说法中正确的是 ( )
| A.1 mol/L的NaCl溶液是指由1 mol NaCl和1000mL水配制成的溶液 |
| B.从1 L 0.5 mol/L的NaCl溶液中取出100 mL,,剩余溶液物质的量浓度为0.45mol/L |
| C.0℃时,2 mol Cl2的体积可能为22.4 L |
| D.11.2L HCl气体通入水中,溶解后配成1L溶液,所得溶液物质的量浓度为0.5mol/L |
下列电离方程式书写正确的是()
| A.H2SO4=2H++SO42- | B.NaHCO3=Na++H++CO32- |
| C.KClO3=K++Cl-+3O2- | D.NaHSO4=Na++HSO4- |
下列各组物质分类正确的是 ( )
| 酸 |
碱 |
盐 |
氧化物 |
|
| A |
硫酸 |
纯碱 |
石灰石 |
水 |
| B |
盐酸 |
烧碱 |
纯碱 |
生石灰 |
| C |
碳酸 |
胆矾 |
熟石灰 |
干冰 |
| D |
干冰 |
苛性钾 |
食盐 |
石灰石 |