铁是一种历史悠久、应用最广泛、用量最大的金属。有三位同学分别用铁粉
进行如下探究实验:
(1) 甲同学用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
①步骤②中,除发生反应Fe+2HCl FeCl2+H2↑外,其他可能反应的离子方程式
为: 。
②可以验证溶液B中是否含有Fe2+的一种试剂是 (填选项序号)
a.稀硫酸 b.铁 c.硫氰化钾 d.酸性高锰酸钾溶液
(2)乙同学欲用少量Fe粉与足量浓硫酸反应得到硫酸亚铁。有人认为不论常温还是加热的条件下均不可行,理由是
于是乙同学将上述方案做如下改进后可获得FeSO4·7H2O,请填写下列括号中的空白: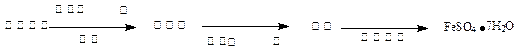 (3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是
(3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是
.
亚硝酸钠(NaNO2)是一种外观与食盐相似的食品添加剂。兴趣小组用如下装置制NaNO2 (夹持和加热装置已省略)。已知:2NO+Na2O2 = 2NaNO2;2NO2+Na2O2 = 2NaNO3。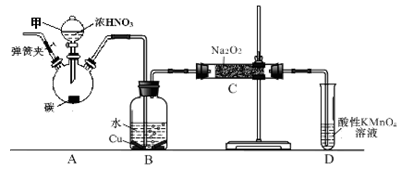
(1)仪器甲的名称是___;装置A烧瓶中发生反应的化学方程式为。
(2)B装置的作用是。
写出所发生主要反应的化学方程式①;② ___________。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是(填字母)。
A.浓H2SO4B.碱石灰C.无水CaCl2
(4)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为____ _________。
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2。为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101 kPa,温度为0 ℃)。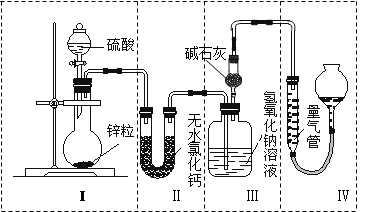
(1)若在烧瓶中放入0.65 g锌粒,与c mol·L-1的H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是。
A.200 mLB.300 mL C.400 mL
(2)若0.65g锌粒完全溶解,装置Ⅲ 增重0.64 g,则圆底烧瓶中发生反应的化学方程式为
;
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气管中收集到V mL气体,则有:a g÷65 g·mol-1×2=b g÷64 g·mol-1×2+V mL÷22400 mL·mol-1×2,该等式依据的原理是;
(4)若在烧瓶中投入10g锌,加入一定量的18 mol·L-1浓硫酸10 mL,充分反应后锌有剩余,测得装置Ⅲ 增重3.2 g,则整个实验过程产生的气体中,m(SO2)/m(H2)=;若撤走装置Ⅱ中盛有无水氯化钙的U形管,m(SO2) / m(H2)的数值将(填“偏大”、“偏小”或“无影响”)。
(1)下列有关实验操作或判断不正确的是。
| A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏小 |
| B.用干燥的pH试纸测定氯水的pH |
| C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌 |
| D.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量 |
E.观察钾元素焰色反应的操作:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,观察.
F.制备氢氧化亚铁时,将盛有NaOH溶液的滴管,伸入硫酸亚铁溶液中
(2)除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处。
| 试剂 |
离子反应方程式 |
|
| ①NaHCO3溶液(Na2CO3) |
||
| ② Fe2O3(Al2O3) |
||
| ③FeCl3溶液(FeCl2) |
||
| ④CO2(HCl) |
海洋植物中含有丰富的碘元素,实验室从海藻中提取碘的流程如下图所示:
(1)写出提取碘的过程中有关的实验操作名称:①;③。写出操作③使用的所有玻璃仪器名称,并从下列选项中选出合理的提取用试剂。
A.酒精B.四氯化碳C.醋酸D.汽油
(2)写出操作②中有关反应的离子方程式:,有同学从绿色化学的角度出发提出用H2O2代替Cl2,试说明他的理由。(提示:H2O2+2I-+2H+ = I2+2H2O)
(3)操作③分离出来的废液中含有Cl-、SO42-,现只取一次试液,为了鉴别出Cl-、SO42-,从下列选项中选出依次加入的试剂:足量的、。
A.盐酸酸化的氯化钡 B.硝酸酸化的硝酸银
C.硝酸酸化的硝酸钡 D.硝酸酸化的氯化钡
(4)后期处理采用的是蒸馏操作,装置如图所示,
涉及物质的一些物理性质如下表:
| 物质 |
密度/g·cm-3 |
熔点/℃ |
沸点/℃ |
| 晶态碘(I2) |
4.933 |
113.7 |
184.3 |
| 某有机溶剂 |
1.584 |
-22.92 |
76.72 |
根据上述信息判断,下列说法正确的有。
A.装置图中温度计水银球的位置错误
B.装置图中冷凝水的流向错误
C.仪器A的名称是圆底烧瓶,仪器B的名称是冷凝管
D.蒸馏结束,晶态碘聚集在锥形瓶中
下图为某加碘盐标签的一部分。
已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学想定量测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶液润洗2~3次后,装满溶液,调节液面高度至0刻度。
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下: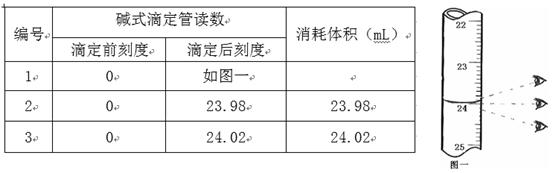
(1)第一次读数为mL。
(2)滴定终点的判断方法。
(3)经过计算,此碘盐碘元素的含量为mg·kg-1(用含a、b的最简表达式表示) 。
(4)下列操作可能会导致测量结果偏低的是。
| A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g |
| B.步骤1所配食盐溶液未完全转移至锥形瓶 |
| C.步骤2中滴定管洗涤后未润洗 |
| D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
(5)请在答题纸的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分)