电解CuCl2和NaCl的混合溶液,最先在阴极和阳极上析出的物质是 ( )
| A.H2和Cl2 | B.Cu和Cl2 | C.H2和O2 | D.Cu和O2 |
按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
下列说法错误的是( )
| A.步骤(1)需要过滤装置 | B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 | D.步骤(4)需要蒸馏装置 |
实验是化学研究的基础,关于下列各实验装置图的叙述中正确的是( )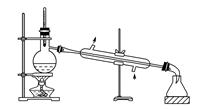
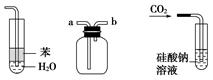
①② ③ ④
| A.装置①:常用于分离互不相溶的液体混合物 |
| B.装置②:可用于吸收NO2或HCl气体,并防止倒吸 |
| C.装置③:先从b口进气集满二氧化碳,再从a口进气,可收集一氧化氮 |
| D.装置④:可用来证明碳的非金属性比硅强 |
下列实验能达到目的的是( )
| A.用CCl4萃取碘水中的碘 |
| B.将足量盐酸加入混有少量CaCO3杂质的Na2SO4中可除去杂质 |
| C.将混有少量HCl的Cl2通入NaOH溶液中除去HCl |
| D.将Fe(OH)3固体加入沸水中制备Fe(OH)3胶体 |
用下列实验装置进行相应实验,能达到实验目的的是( )
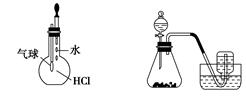
甲 乙 丙 丁
| A.装置甲:除去乙烯中混有的少量SO2 |
| B.装置乙:用浓硫酸配制1 mol/L的硫酸 |
| C.装置丙:检验HCl气体在水中的溶解性 |
| D.装置丁:用铜和浓硝酸反应制取NO2 |
下列实验所用的试纸不能预先用蒸馏水湿润的是( )
| A.用品红试纸检验SO2 |
| B.用淀粉碘化钾试纸检验Cl2 |
| C.用红色石蕊试纸检验氨气 |
| D.用pH试纸测定某溶液的pH |