下列实验能达到目的的是( )
| A.用CCl4萃取碘水中的碘 |
| B.将足量盐酸加入混有少量CaCO3杂质的Na2SO4中可除去杂质 |
| C.将混有少量HCl的Cl2通入NaOH溶液中除去HCl |
| D.将Fe(OH)3固体加入沸水中制备Fe(OH)3胶体 |
按混合物、纯净物、强电解质、弱电解质、非电解质的顺序排列正确的是()
| A.盐酸、氯气、硫酸钡、二氧化碳、二氧化硫 |
| B.硫酸、氨水、醋酸、乙醇、二氧化氮 |
| C.漂白粉、胆矾、碳酸钙、醋酸、二氧化碳 |
| D.干冰、氯水、氯化氢、次氯酸、一氧化碳 |
能使H2O+H2O≒H3O++OH-的电离平衡向电离方向移动,但所得溶液仍呈中性的是()
| A.加入硫酸 | B.加入少量氯化铵晶体 | C.继续加水 | D.升温 |
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
| A.由反应①、②可推知:CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1 |
| B.等物质的量的甲烷分别参与反应①、②,则反应转移的电子数相等 |
| C.若用标准状况下4.48 L CH4还原NO2至N2,放出的热量为 173.4 kJ |
| D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为3.2NA |
下列说法不正确的是()
| A.在25 ℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) |
| B.0.1 mol·L-1醋酸溶液中:c2(H+)=c(H+)·c(CH3COO-)+KW |
C.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如下图所示,当pH=4.5时,溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| D.等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后 |
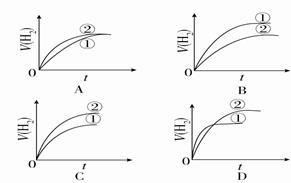
相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )