下列反应中不属于化合、分解、置换、复分解等四种基本反应类型的是
| A.CuSO4 + H2S =" CuS↓" + H2SO4 | B.2FeCl3 + Cu = 2FeCl2 + CuCl2 |
| C.Cu2(OH)2CO3=" 2CuO" + CO2↑ + H2O | D.4Fe(OH)2 + O2+ 2H2O = 4Fe(OH)3 |
6.某有机小分子化合物含有C、H、O、N四种元素,该有机物可能是 ( )
A.脂肪 B. 蛋白质 C. 葡萄糖D. 氨基酸
纳米材料的表面粒子占总粒子的比例极大,这是它有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状与氯化钠晶胞的大小和形状相同,则这种纳米颗粒的表面粒子数与总粒子数的比值为()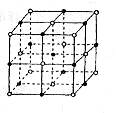
| A.7:8 | B.13:14 | C.25:26 | D.26:27 |
某原电池的总反应是Zn +Cu2+=Zn2++ Cu,该原电池的正确组成是 ( )
下列说法正确的是 ( )
| A.中和热一定是强酸跟强碱反应放出的热量 |
| B.1 mol酸与1 mol碱完全反应放出的热量是中和热 |
| C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O时的反应热叫做中和热 |
| D.表示中和热的离子方程式为:H+(aq)+OH-(aq)=H2O(l); △H=57.3KJ/mol |
下列各组离子在给定条件的溶液中可能大量共存的是 ( )
| A.加入铝粉有大量氢气产生的溶液中:Mg2+、K+、NO3-、C1- |
| B.PH = 0的无色溶液中:Na+、K+、MnO4-、NO3- |
| C.在0.1mol/L的醋酸溶液中:Fe2+、Na+、ClO-、Ca2+ |
| D.在c(OH-)= 1×10-13的溶液中:NH4+、Ca2+、C1-、K+ |