氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)下图是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式: 。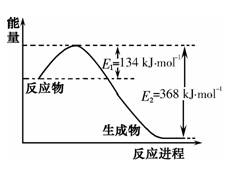
(2)已知: CO(g)+1/2 O2(g) = CO2(g) △H = -283 kJ/mol
N2(g)+ O2(g) =" " 2 NO(g) △H = +180 kJ/mol
则反应2 NO(g)+2 CO(g) N2(g) + 2 CO2(g) △H = kJ/mol。
N2(g) + 2 CO2(g) △H = kJ/mol。
(3)在固定体积的密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g);△H<0,其平衡常数K与温度T的关系如下表:
2NH3(g);△H<0,其平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
① 写出该反应的平衡常数表达式:K =
② 试判断K1 K2(填写“>”“=”或“<”)
③下列各项能说明该反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(H2)(逆) =)3v(N2)(正)
c.容器内压强保持不变 d.混合气体的密度保持不变
④若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比为1:3:2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度 (填增大、不变或减小,下同),NH3的体积分数 。
奥运吉祥物福娃外材为纯羊毛线,内充物为无毒的聚酯纤维 。下列说法正确的是( )
。下列说法正确的是( )
| A.羊毛与聚酯纤维的化学成分相同 |
| B.聚酯纤维和羊毛一定条件下均能水解 |
| C.该聚酯纤维单体为对苯二甲酸和乙醇 |
| D.由单体合成聚酯纤维的反应属缩聚反应 |
下列原料或制品中,若出现破损不可以进行修补的是( )
| A.聚氯乙烯凉鞋 | B.电木插座 | C.自行车内胎 | D.聚乙烯塑料 |
硅橡胶是一种医用高分子材料,用于人造心脏、人造肌肉、人造皮肤等。它具有良好的生物相容性和稳定性,有足够的机械强度,而且易于加工、消毒。硅橡胶是一种耐高温橡胶,它是由二甲基二氯硅烷经过两步反应制得: ,
,
其合成过程中涉及的反应类型分别是( )
①水解反应 ②加成反应 ③加聚反应 ④缩聚反应
| A.①③ | B.①② | C.②④ | D.①④ |
下列几种橡胶中,最不稳定、长期见光与空气作用就会逐渐被氧化而变硬变脆的是( )
A.天然橡胶(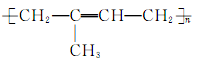 ) ) |
B.硅橡胶( ) ) |
C.聚硫橡胶( ) ) |
D.硫化橡胶(天然橡胶中加硫磺,使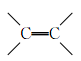 断裂,使其由线型结构变成体型结构) 断裂,使其由线型结构变成体型结构) |
2008年北京奥运会突出“绿色奥运、科技奥运、人文奥运”的理念。下列说法错误的是( )
| A.奥运场馆建设均使用天然材料,不使用合成材料 |
| B.建筑“鸟巢”使用的钒氮钢属于合金 |
| C.可用灼烧、闻是否有烧焦羽毛气味的方法判断“福娃”面料是羊毛还是合成纤维 |
D.“水立方”采用的ETFE膜(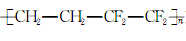 )由两种单体加聚而成 )由两种单体加聚而成 |