某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体)。下列分析或结果不正确的是 ( )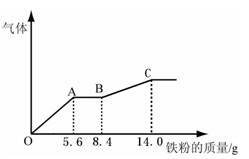
| A.原混合酸中NO3-物质的量为0.2 mol |
| B.原混合酸中H2SO4浓度为2 mol·L-1 |
| C.OA段产生的气体是NO,AB段的反应为Fe+2Fe3+=3Fe2+, BC段产生的气体是氢气 |
| D.第二份溶液中最终溶质为FeSO4 |
下列离子方程式正确的是()
A.乙酸与碳酸钠溶液反应:2H++CO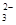 == CO2↑+H2O == CO2↑+H2O |
| B.醋酸溶液与新制氢氧化铜反应:CH3COOH+OH— —→CH3COO-+H2O |
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O—→ 2C6H5OH+CO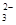 |
D.用银氨溶液检验乙醛中的醛基:CH3CHO +2[Ag(NH3)2]+ + 2OH- CH3COO-+ NH4+ +3NH3 + 2Ag↓+ H2O CH3COO-+ NH4+ +3NH3 + 2Ag↓+ H2O |
已知酸性:H2SO4 > 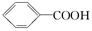 >H2CO3>
>H2CO3> 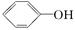 > HCO3—,综合考虑反应物的转化率和原料成本等因素,将
> HCO3—,综合考虑反应物的转化率和原料成本等因素,将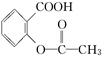 转变为
转变为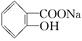 的最佳方法是()
的最佳方法是()
| A.与稀H2SO4共热后,加入足量的NaOH溶液 |
| B.与稀H2SO4共热后,加入足量的Na2CO3溶液 |
| C.与足量的NaOH溶液共热后,再通入足量CO2 |
| D.与足量的NaOH溶液共热后,再加入适量H2SO4 |
下列各组有机物,无论它们以何种物质的量的比例混合,只要总物质的量一定,则在完全燃烧时,消耗氧气的量为一定值的是()
| A.C2H6和C3H8 | B.C4H10和C6H6 | C.C2H6O和C2H4O2 | D.C3H6和C3H8O |
用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,当反应达到平衡时,下列说法正确的是( )
| A.18O只存在于乙酸乙酯中 |
| B.18O存在于水、乙酸、乙醇以及乙酸乙酯中 |
| C.18O存在于乙酸乙酯、乙醇中 |
| D.该乙醇若与丙酸反应生成酯的相对分子质量为102 |
有下列物质:①乙醇;②苯酚;③乙醛;④丙烯酸(CH2=CHCOOH);⑤乙酸乙酯。其中与溴水、酸性KMnO4溶液、NaOH溶液都能反应的是()
| A.①③ | B.②⑤ | C.②④ | D.③④ |