A、B、C、D、E、F六种短周期元素,原子序数依次增大。A、E同主族,且E元素原子的核外电子数是A元素原子核内质子数的两倍。B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数。D元素原子最外层电子数是次外层电子数的一半。回答下列问题:
(1) 写出元素D基态原子的电子排布图: ;
(2)用电子式表示B、F两元素形成化合物的过程: ;
(3)A的气态氢化物的沸点 (填“高于”、“低于”)E的气态氢化物的稳定性;原因是: 。
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:2H2O(g) 2H2(g)+O2(g)△H = +484kJ·mol—1,不同时段产生O2的量见下表:
2H2(g)+O2(g)△H = +484kJ·mol—1,不同时段产生O2的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
上述反应过程中能量转化形式为光能转化为 能,达平衡过程中至少需要吸收光能为 kJ。
(2)现有反应:CO(g)+ H2O(g)  CO2(g)+ H2(g) △H<0,在相同温度和相同体积下进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO2(g)+ H2(g) △H<0,在相同温度和相同体积下进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| 物质的量 |
CO |
H2 O |
CO2 |
H2 |
| 甲 |
a mol |
a mol |
0 mol |
0 mol |
| 乙 |
0mol |
0 mol |
2a mol |
a mol |
| 丙 |
0 mol |
0 mol |
a mol |
a mol |
| 丁 |
a mol |
a mol |
a mol |
a mol |
上述四种情况达到平衡后,甲、乙、丙、丁容器中n(CO)的大小顺序为 。
(3)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3得金属钨,总反应为WO3 (s) + 3H2 (g) W (s) + 3H2O (g)。请回答下列问题:
W (s) + 3H2O (g)。请回答下列问题:
①某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为 。
②上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 |
25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 |
WO3W2O5WO2 W |
假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 。
③钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) WI4 (g)。下列说法正确的有 (填字母)。
WI4 (g)。下列说法正确的有 (填字母)。
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)。
2Cl2(g)+2H2O(g)。
(1)研究表明反应A通过如下图所示的催化剂循环实现。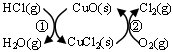
反应①为:2HCl(g)+CuO(s) H2O(g)+CuCl2(g) ΔH1
H2O(g)+CuCl2(g) ΔH1
反应②生成1molCl2(g)的反应热为ΔH2,则A反应的反应热表示为 。(用ΔH1和ΔH2表示)。
(2)反应A中,4mol HCl被氧化,放出115.6kJ的热量,且部分化学键断裂示意图如下: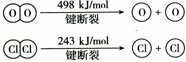
①H2O的电子式是 ,反应A的热化学方程式是 。
②断开1 mol H—O键与断开 1 mol H—Cl 键所需能量相差约为 kJ,H2O中H—O 键比HCl中H—Cl键 (填“强”或“弱”)。
(3)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。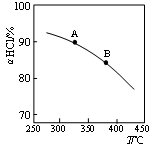
实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的ɑHCl—T曲线如上图所示,若压缩体积使压强增大,画出相应ɑHCl—T曲线的示意图,并简要说明理由 。
甲醇既是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)  CH3OH(g) ΔH1=-99 kJ·mol-1
CH3OH(g) ΔH1=-99 kJ·mol-1
②CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH2="—58" kJ·mol-1
CH3OH(g)+H2O(g) ΔH2="—58" kJ·mol-1
③CO2(g)+H2(g)  CO(g)+H2O(g) ΔH3=+41 kJ·mol-1
CO(g)+H2O(g) ΔH3=+41 kJ·mol-1
回答下列问题:
(1)反应①的化学平衡常数K的表达式为 。下图中能正确反映该反应平衡常数K随温度变化关系的曲线为 (填“a”或“b”),其判断理由是 。
(2)合成气的组成 时,体系中的CO平衡转化率(a)随温度升高而减小,分析其主要原因有:反应①为放热反应,平衡向左移动,使得体系中CO的量增大;还有 。
时,体系中的CO平衡转化率(a)随温度升高而减小,分析其主要原因有:反应①为放热反应,平衡向左移动,使得体系中CO的量增大;还有 。
(3)若在一定条件下,容积恒定为VL的反应室中充入amolCO与2amolH2,在催化剂作用下仅发生反应①,下列措施一定使c(CH3OH)/c(CO)增大的是 (填字母)。
| A.升高温度 | B.充入Ar(g)使体系的总压增大 |
| C.恒温恒容再充入H2 | D.恒温恒容再充入a mol CO和2a mol H2 |
白云石的主要成份是CaCO3·MgCO3,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、熔化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离。
已知:碳化反应是放热反应,化学方程式Ca(OH)2+Mg(OH)2+3CO2 CaCO3+Mg(HCO3)2+H2O。完成下列填空:
CaCO3+Mg(HCO3)2+H2O。完成下列填空:
(1)Ca(OH)2的碱性比Mg(OH)2的碱性 (填“强”或“弱”)
Ca(OH)2的溶解度比Mg(OH)2的溶解度 (填“大”或“小”)。
(2)碳化温度保持在50~60℃。温度偏高不利于碳化反应,原因是 、 (至少写2点)。温度偏低也不利于碳化反应,原因是 。
(3)已知某次碳化时溶液中钙离子浓度随时间的变化如图所示,在10min到13min之内钙离子的反应速率为 。用化学方程式表示15min之后钙离子浓度增大的原因 。
利用化学反应原理解决下列问题。
(1)在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl— [CuCl4]2—(绿)+4H2O,请写出一个能使黄绿色CuCl2溶液向蓝色转化的操作是 。
[CuCl4]2—(绿)+4H2O,请写出一个能使黄绿色CuCl2溶液向蓝色转化的操作是 。
(2)将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了 。
(3)乙苯催化脱氢制苯乙烯反应:  △H="+124" kJ·mol-1,工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。
△H="+124" kJ·mol-1,工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。
在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,说明水蒸气的加入相当于 (填“加压”或“减压”)的效果。
②控制反应温度为600℃的理由是 。