有机物A的结构简式为:
(1)A的分子式为____________________。
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物。当有1 molA发生反应时,最多消耗_________ mol NaOH。
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简式为___________________________________________________________________。
(4)写出苯环上只有 一个取代基且属于酯类的D的所有同分异构体的结构简式 。
一个取代基且属于酯类的D的所有同分异构体的结构简式 。
(5)D的某同系物在氧气中充分燃烧生成二氧化碳和水,其中n(CO2)∶n(H2O)=3∶2,该同系物的分子式为_______________________。
近年来,乳酸成为研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过发酵法制备。利用乳酸 为原料制成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
为原料制成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
(1)请写出乳酸分子中官能团的名称、。
(2)乳酸能与纯铁粉反应制备一种补铁药物
该反应中的还原剂是____________
(3)乳酸聚合成的纤维非常适合做手术缝合线,其原因是
。
(4)乳酸发生下列变化
所用的试剂是a,b(写化学式)
(5)请写出下列反应的化学方程式,并注明反应类型:
①乳酸与乙醇的反应;
X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大。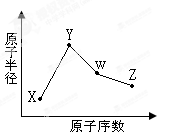
(1)W位于元素周期表中第周期第族画出X的阴离子的结构示意图。
(2)Z的氢化物和溴化氢相比,较稳定的是(写化学式);Z的氢化物与氟化氢相比,沸点较高的是(写化学式)。
(3)Y的金属性与Mg的金属性相比,(写化学式)的金属性强,请用实验证明它们金属性的相对强弱:。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式。
[化学——选修有机化学基础]
Ⅰ.请选出下列各题中符合题意的选项:
(1)下列不可能存在的有机物是
A.2—甲基丙烷 B.2,3—二氯—2,2—二甲基戊烷
C.3—溴—3—乙基戊烷 D.2,2,3,3—四甲基丁烷
(2)能在KOH的醇溶液中发生消去反应的是
(3)某有机物既能发生氧化反应,又能发生还原反应,且氧化产物和还原产物能发生酯化反应,所生成的酯也能发生银镜反应。则该有机物的结构简式是
A.CH3OH B.HCHO
C.HCOOH D.HCOOCH3
Ⅱ.有机物A的结构简式为:
据此回答下列问题:
(1)A的分子式为__________。
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物。当有1 mol A发生反应时,最多消耗mol NaOH。
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简式为。
(4)写出苯环上只有一个取代基且属于酯类的D的所有同分异构体的结构简式:。
[化学——选修物质结构与性质]
Ⅰ.请选出下列各题中符合题意的选项:
(1)下列物质中,属于含有共价键的离子晶体是
A.CsCl B.KOH C.H2O D.H2
(2)已知CsCl晶体的密度为 ,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为
,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为
A. g/mol B.
g/mol B. g/mol
g/mol
C. g/mol D.
g/mol D. g/mol
g/mol
(3)已知含氧酸可用通式XOm(OH)n来表示,如X是S,m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m的值越大,该含氧酸的酸性越强。下列各含氧酸中酸性最强的是
A.HMnO4 B.H2SeO3 C.H3BO3 D.H3PO4
Ⅱ.现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| A |
原子的电子排布图为 |
| B |
常温下单质为双原子分子,原子间形成三对共用电子对 |
| C |
原子的s轨道电子数等于p轨道电子数,元素的最低负价为-2价 |
| D |
二价阳离子与C的阴离子具有相同的电子层结构 |
| E |
原子序数是D两倍, |
根据以上情况,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为;
(2)B的氢化物的分子空间构型是;
(3)E在周期表中的位置是,ECl3能与B、C的氢化物形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界,ECl3形成的配合物的化学式为;
(4)AC2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中A原子的杂化形式为;
(5)D 的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:。
[化学—选修化学与技术]
Ⅰ.请选出下列各题中符合题意的选项:
(1)下列污水处理方法只涉及物理变化的是
A.过滤法 B.氧化还原法 C.中和法 D.化学沉淀法
(2)目前下列工艺过程没有直接使用离子交换技术的是
A.硬水的软化 B.电解饱和食盐水制造NaOH
C.电渗析淡化海水 D.海水中提取金属Mg
(3)根据课本的介绍,下列工业生产过程中不需要使用氨水或氨气的是
A.硫酸的工业制法 B.石油的催化裂化
C.硝酸的工业制法 D.侯氏制碱法
Ⅱ.水处理技术在生产、生活中应用广泛。
(1)含有较多离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为(写出一个即可)。
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过(填“RH”或“ROH”)型离子交换树脂,原因是。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为。电渗析法净化水时,使离子通过半透膜的推动力是。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的。