某学生发现氯水能使有色布条褪色,氯水的成分比较复杂,那么氯水中究竟什么成分具有漂白性呢?带着疑问,他做了如下探究:
(1)查找资料后得知氯水的成分有____、___、____、____。
(2)根据资料查阅和实验结果分析, 新制的氯水呈____色,氯水中含有多种微粒.将紫色石蕊试液滴入其中,溶液显红色.起作用的微粒是 ;过一会儿,溶液的颜色逐渐褪去,起作用的微粒是 。该物质之所以具有漂白性,与它的____ __(填性质)有关。往氯水中滴入硝酸银溶液,产生白色沉淀,起作用的微粒是 。氯水能使淀粉碘化钾试纸变蓝,起作用的是 .(本小题中除第一个外,其余每个空格处都请填写微粒的符号)
(3)从以上过程可看出,该学生的探究活动体现了最基本的科学研究方法,即:
【2015上海化学】(本题共12分)过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②不断搅拌的同时加入30% H2O2,反应生成CaO2·8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
完成下列填空
(1)第①步反应的化学方程式为 。第②步反应的化学方程式为 。
(2)可循环使用的物质是 。
工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产,这是因为 。
(3)检验CaO2·8H2O是否洗净的方法是 。
(4)CaO2·8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是 、 。
(5)已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。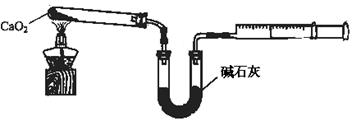
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。
过氧化钙的含量也可用重量法测定,需要测定的物理量有 。
【2015北京理综化学】研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式: 。
(2)在海洋循环中,通过下图所示的途径固碳。
①写出钙化作用的离子方程式: 。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整: + ===(CH2O)x+x18O2+xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的还说中吹出CO2并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。
②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymlHCl溶液,海水中溶解无机碳的浓度= mol/L。
(4)利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
①结合方程式简述提取CO2的原理: 。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是 。
【2015广东理综化学】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
(1)煅粉主要含MgO和 ,用适量的NH4NO3溶液浸取煅粉后,镁化合物几乎不溶, 若溶液I中c(Mg2+)小于5×10-6mol·L-1,则溶液pH大于 (Mg(OH)2的Ksp=5×10-12);该工艺中不能用(NH4)2SO4代替NH4NO3,原因是 。
(2)滤液I中的阴离子有 (忽略杂质成分的影响);若滤液I中仅通入CO2,会生成 ,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为 。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
(5)一种可超快充电的新型铝电池,充放电时AlCl4—和Al2Cl7—两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为 。
【2015安徽理综化学】硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:13℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是_____,原料中的金属钠通常保存在____中,实验室取用少量金属钠需要用到的实验用品有_____,_____,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:
□NaBO2+□SiO2+□Na+□H2==□NaBH4+□Na2SiO3
(3)第②步分离采用的方法是______;第③步分离(NaBH4)并回收溶剂,采用的方法是______。
(4)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25℃,101KPa下,已知每消耗3.8克NaBH4(s)放热21.6KJ,该反应的热化学方程式是_______。
【2015福建理综化学】(15分)无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为 。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
已知:
| 物质 |
SiCl4 |
AlCl3 |
FeCl3 |
FeCl2 |
| 沸点/℃ |
57.6 |
180(升华) |
300(升华) |
1023 |
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是 (只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是 。
③已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g)ΔH1="+1344.1kJ" ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g)ΔH2="+1169.2kJ" ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为 。
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为_______。
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是 。