(12分)依据事实,写出下列反应的热化学方程式。
⑴在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________
⑵若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量。____________________________________________________________________
⑶用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。___________________________________
⑷已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
亚铁是血红蛋白重要组成成分,起着向人体组织传送O2的作用,如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种常见补药品说明书中的部分内容:该药品含Fe2+33%~36%,不溶于水但能溶于人体中的胃酸:与Vc(维生素C)同服可增加本品吸收。
(一)甲同学设计了以下下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:
(1)加入新制氯水后溶液中发生的离子反应方程式是_____________、Fe3+ +3SCN-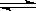 Fe(SCN)3 。
Fe(SCN)3 。
(2)加入KSCN溶液后溶液变为淡红色,说明溶液中有少量Fe3+。该离子存在的原因可能是____(填编号)。
A.药品中的铁本来就应该以三价铁的形式存在
B.在制药过程中生成少量三价铁
C.药品储存过程中有少量三价铁生成
(3)药品说明书中“与Vc同服可增加本品吸收”请说明理由_______________________。
(二)乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为5Fe2++MnO4+8H+=5Fe3++ Mn2++4H2O。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
(4)该实验中的试剂2与甲同学设计的实验中的试剂1都可以是 (填序号)。
A.蒸馏水 B.稀盐酸 C.稀硫酸 D.稀硝酸
(5)本实验滴定过程中操作滴定管的图示正确的是_______(填编号)。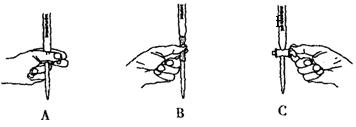
(6)请通过计算,说明该药品含“铁”量是否合格(写出主要计算过程)?
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250 mL溶液。
方案一:沉淀法。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂是 (填编号)。
| A.CaCl2溶液 | B.MgSO4溶液 | C.NaCl溶液 | D.Ba(OH)2溶液 |
(2)过滤,提取沉淀,则过滤操作所需要的玻璃仪器除烧杯外,还有 。
(3)将沉淀洗涤,并充分干燥,称量沉淀的质量为mg,由此可以计算(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得ω(Na2CO3) (填“偏大”、“偏小"或“无影响")。
方案二:量气法。量取10.00 mL配制好的溶液与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃、1.01×105 Pa)的体积,由此计算混合物中W(Na2CO3)。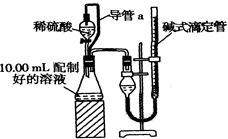
(1)装置中导管a的作用是 。若撤去导管a,使测得气体体积(“偏大”,“偏小”或“无影响”)
(2)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
① ,② ,③眼睛视线与液面最低处相平。
(3)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生CO2的体积为 ml。
方案三:滴定法。量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L的盐酸滴定到终点(已知终点时反应H++CO32—=HCO3—恰好完全)。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。
(1)量取25.00 mL配制好的溶液,应选择 仪器来完成。
(2)判断滴定终点的依据是 。
(3)此法测得ω(Na2CO3)= %。
绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药。某学校的化学兴趣小组的同学对绿矾进行了如下的探究:
(一)FeSO4•7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4•7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 。
(2)实验步骤②明显不合理,理由是 。
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是 。
(二)探究绿矾(FeSO4·7H2O)热分解的产物
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):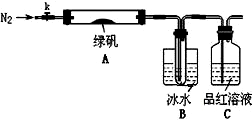
【实验过程】
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是 ;
结论2:C中溶液褪色,可推知产物中有 ;
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足: 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是 。
a.氯水和KSCN溶液 b.酸性KMnO4溶液
c.H2O2 d.NaOH溶液
废旧物的回收利用既有利于节约资源,又有利于保护环境。某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4·7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下: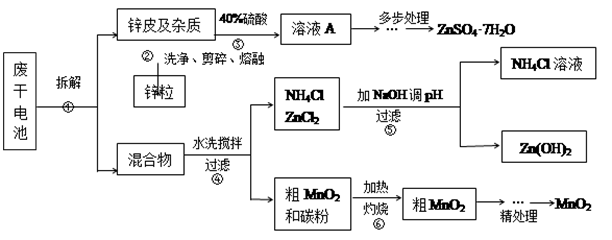
(1)操作②中所用的加热仪器应选 (选填“蒸发皿”或“坩埚”)。
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+沉淀,请写出氨水和Fe3+反应的离子方程式 。
(3)操作⑤是为了除去溶液中的Zn2+。已知25℃时,
| NH3·H2O的Kb |
Zn2+完全沉淀的pH |
Zn(OH)2溶于碱的pH |
| 1.8×10-5 |
8.9 |
>11 |
由上表数据分析应调节溶液pH最好为 (填序号)。
a.9 b.10 c.11
(4)MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol/L的H2SO4的混和液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+)。反应生成MnSO4的离子方程式为 ;
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe3+沉淀完全,再加活性炭搅拌,抽滤。加活性炭的作用是 ;
步骤3:向滤液中滴加0.5mol/L的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,灼烧至黑褐色,生成MnO2。灼烧过程中反应的化学方程式为 。
(5)查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体。
①在盐酸和硝酸溶液的浓度均为5mol/L、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图,由图看出两种酸的最佳浸泡温度都在 ℃左右;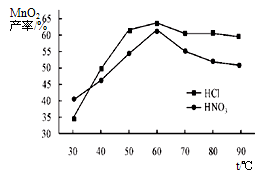
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如下图,由图看出硝酸的最佳浓度应选择 mol/L左右。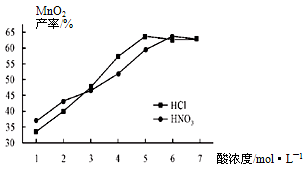
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.84g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的十分之一置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20mL。请回答下列问题:
(1)将样品研细后再反应,其目的是 。
(2)装置a和c的作用分别是_ ___和__ __(填标号,可以多选)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是 。
(4)通过计算可知,该黄铜矿的纯度为 。
(5)若用下图装置替代上述实验装置d,同样可以达到实验目的的是 (填序号)。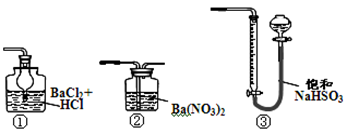
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度会产生误差,假设实验操作均正确,可能的原因主要有_______________________________________。