四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 |
T |
X |
Y |
Z |
| 性质 结构 信息 |
人体内含量最多的元素,且其单质是常见的助燃剂。 |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的离子结构示意图 ;写出元素X的气态氢化物的电子式 。
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式 。
(3)Z的最高价氧化物对应水化物的电离方程式 。
(4)元素T与氟元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数之比为2:3:3,向溶液中通入氯气,使溶液中Cl-和Br-的个数比为7:3,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为(已知还原性I->Fe2+>Br->Cl-)
| A.5:4 | B.4:5 | C.5:12 | D.12:5 |
某溶液中所含离子及其浓度如下表,则Mn+及a值可能为
| 所含离子 |
NO3- |
SO42- |
H+ |
Na+ |
Mn+ |
| 浓度(mol/L) |
3 |
1 |
2 |
1 |
A |
A.Mg2+、1 B.Ba2+、0.5 C.Al3+、1.5 D.Fe2+、 2
如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g。下列说法正确的是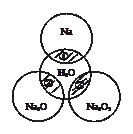
| A.Na2O2中阴阳离子数目之比为1:1 |
| B.反应①的离子方程式为:Na + 2H2O =Na+ + 2OH- + H2↑ |
| C.反应③最多能产生0.05mol O2 |
| D.①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③ |
下列反应能用:H++OH-=H2O表示的是
| A.盐酸溶液与氨水混合 | B.NaHSO4溶液与Ba(OH)2溶液混合 |
| C.NaHCO3溶液与NaOH溶液混合 | D.Ca(OH)2溶液与硝酸溶液混合 |
某温度下,饱和石灰水的溶解度为s g ,密度为 ρg/mL,向足量该饱和溶液中加入 m g CaO,充分作用后,恢复到原来温度,下列有关说法不正确的是
A.最终得到沉淀的质量大于 |
B.该饱和溶液质量百分比浓度为: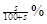 |
| C.最终所得溶液PH不变 |
D.该饱和溶液中溶质物质的量浓度为: mol/L mol/L |