下列各组物质的水溶液不用试剂无法鉴别出来的是
| A.NaOH、AlCl3 | B.CuSO4、BaCl2 | C.NaAlO2、HCl | D.MgCl2、AlCl3 |
设NA表示阿伏加德罗常数的值,下列说法中正确的是()
| A.1 mol NH4+所含质子数为11NA |
| B.18g水中含有的电子数目为3 NA |
| C.标准状况下,11.2L水所含分子数为0.5NA |
| D.常温常压下,48gO3含有的氧原子数为NA |
现有下列四种因素:①温度和压强②所含微粒数③微粒本身大小 ④ 微粒间的距离,其中对气体物质体积有显著影响的是()
| A.① ② ③ | B.① ③ ④ |
| C.① ② ④ | D.① ② ③ ④ |
下列物质属于非电解质的是()
| A.HCl | B.Fe | C.蔗糖溶液 | D.CH3CH2OH |
下列反应不属于四种基本反应类型,但属于氧化还原反应的是()
| A.Fe + CuSO4 ="=" FeSO4+ Cu | |
B.AgNO3+ NaCl ="=" AgCl↓ + NaNO3 |
C.MnO2 + 4 HCl(浓) MnCl2+ Cl2↑ + 2 H2O |
D.2KMnO4 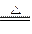 K2MnO4 + MnO2 + O2↑ K2MnO4 + MnO2 + O2↑ |
下列物质中属于纯净物、化合物、钙盐的是()
| A.生石灰 | B.熟石灰 | C.碳酸钙 | D.石灰石 |