某稀溶液中含有等物质的量的ZnSO4、Fe2(SO4)3、H2SO4、CuSO4,向其中逐渐加入铁粉。下列各图表示溶液中Fe2+的物质的量和加入铁粉的物质的量之间的关系,其中可能正确的是
A B C D
下列离子方程式书写正确的是
| A.Cu与FeCl3溶液反应:Cu+ Fe3+= Cu2++ Fe2+ |
| B.碳酸钙溶于稀盐酸:CO32- + 2H+ = H2O + CO2↑ |
| C.FeSO4溶液和NaOH溶液反应: Fe2+ + 2OH- = Fe(OH)2↓ |
| D.氯气溶于水:Cl2 + H2O = 2H+ + ClO- + Cl- |
下列有关工业生产的叙述中错误的是
| A.电解氯化钠溶液制金属钠 |
| B.石灰石是炼铁和制玻璃的原料之一 |
| C.氯气通入石灰乳中制漂白粉 |
| D.硫酸工业的主要设备有沸腾炉、接触室、吸收塔 |
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是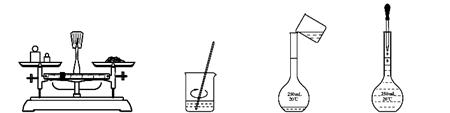
AB C D
下列各组离子在溶液中能大量共存的是
| A.K+、Na+、SO42-、CO32- | B.NH4+、Na+、SO42-、OH- |
| C.H+、K+、HCO3-、Cl- | D.Al3+、K+、OH-、NO3- |
下列除去杂质的方法中,正确的是
| 选项 |
物质(括号内为杂质) |
试剂 |
方法 |
| A |
Cl2(HCl ) |
NaOH溶液 |
洗气 |
| B |
Fe(Al) |
NaOH溶液 |
过滤 |
| C |
CO2(CO) |
O2 |
点燃 |
| D |
KNO3(KOH) |
FeCl3溶液 |
过滤 |