下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为 。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(4)由表中两种元素的原子按1︰1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) _。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: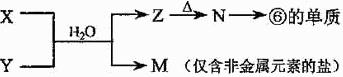
X溶液与Y溶液反应的离子方程式为 ,N→⑥的单质的化学方程式为 。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 。
(Ⅰ)室温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 |
HA的物质的量 浓度(mol/L) |
NaOH的物质的 量浓度(mol/L) |
混合后 溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? 。
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是
A.前者大B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=________mol/L。
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B===H++HB-HB- H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(III)已知:25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(6)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)_____________。万一误服了少量BaCO3,应尽快用大量0.5 mol/L Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为_____mol/L。
如下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。
(1)甲池是________装置。
(2)乙池中A(石墨)电极的名称是________。
(3)写出通入CH3OH的电极的电极反应式:_________________________。
(4)乙池中反应的化学方程式为______________________________________。
(5)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2________ mL(标准状况);此时丙池某电极上析出1.60 g某金属,则丙池中的某盐溶液可能是________(填序号)。
| A.MgSO4 | B.CuSO4 | C.NaCl | D.AgNO3 |
(1)下列各组物质:①金刚石和C60②H、D和T③乙烷和已烷④CH3(CH2)2CH3和(CH3)2CHCH3中,互为同位素的是(填序号,下同)__ ___,互为同素异形体的是_ __,互为同系物的是_____,属于同分异构体的是__ ___。
(2)请写出2,3-二甲基丁烷的结构简式: 。
(3)请用系统命名法命名该烷烃CH3CH(C2H5)CH(CH3)2: 。
(1)已知:
① 2H2(g)+O2(g)=2H2O(l) △H1=" -a" kJ•mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 =" -b" kJ•mol-1
③ CO(g)+2H2(g) CH3OH(g) △H3 =" -c" kJ•mol-1
CH3OH(g) △H3 =" -c" kJ•mol-1
计算甲醇蒸气的标准燃烧热 =
=
(2)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
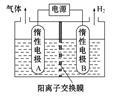
①利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为 溶液(填化学式),阳极电极反应式为 ,电解过程中Li+向 电极迁移(填“A”或“B”)。
②利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下: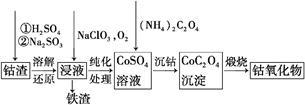
Co(OH)3溶解还原反应的离子方程式为 。
(1)砷(As)与其化合物被广泛应用在农药、除草剂、杀虫剂以及含砷药物中。回答下列问题:
①砷是氮的同族元素,且比氮多2个电子层,砷在元素周期表中的位置: ;AsH3的热稳定性比NH3的热稳定性 (填“强”或“弱”)。
②As2O3俗称砒霜,As2O3是两性偏酸性氧化物,是亚砷酸(H3AsO3)的酸
酐,易溶于碱生成亚砷酸盐,写出As2O3与足量氢氧化钠溶液反应的离子
方程式 。
③As2S3和HNO3反应如下:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,将该反应设计成原电池,则NO2应该在 (填“正极”或“负极”)附近逸出,该极的电极反应式为 。
(2)综合利用CO2对环境保护及能源开发意义重大。Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是 。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找